Ronald Palacios Castrillo
Resumen
La conducta está estrechamente sincronizada con la fisiología corporal. Las necesidades internas del cuerpo impulsan la selección de la conducta, mientras que el desempeño óptimo de la conducta requiere una respuesta fisiológica coordinada.
El estado interno está representado dinámicamente por el sistema nervioso para influir en el estado de ánimo y la emoción, y las señales cuerpo-cerebro también dirigen las respuestas a las señales sensoriales externas, lo que permite al organismo adaptarse y perseguir sus objetivos en un entorno en constante cambio.
En esta revisión, Sammons,et.al.,[CELL.Volumen 187, Número 2, 1P5877-5890, 2024] examinan la anatomía y la función de la conexión cerebro-cuerpo, que se manifiesta en los niveles de regulación local, refleja y central. Exploran estos bucles jerárquicos en el contexto del sistema inmunológico, específicamente a través de la lente de la inmunocepción, y analizamos el impacto de su desregulación en la salud humana.
=> Recibir por Whatsapp las noticias destacadas
En Detalle
A medida que profundizamos nuestra comprensión de la fisiología del organismo, se hace evidente que nos falta una pieza importante del rompecabezas.
El organismo no actúa como una mera suma de sus componentes; más bien, surgen nuevas propiedades cuando observamos el organismo como una entidad integrada. Hay una notable sincronización en juego: cada órgano ajusta su función al ritmo de otros sistemas fisiológicos y contribuye con sus entradas y necesidades únicas, con el cerebro y el sistema nervioso orquestando toda la sinfonía.
La comunicación cerebro-cuerpo es bidireccional. Por un lado, el sistema nervioso central puede responder a las demandas fisiológicas evocando los comportamientos que pueden satisfacerlas.
Por ejemplo, un organismo puede buscar calor cuando su temperatura corporal baja o anhelar alimentos específicos cuando los nutrientes son deficientes.
Por otro lado, la fisiología debe adaptarse a las necesidades mentales y conductuales, lo que permite al organismo ejecutar eficazmente sus objetivos, como el aumento de la frecuencia cardíaca durante una huida ante el ataque de un depredador. Incluso la mera creencia de que una comida es inminente desencadena señales cerebro-cuerpo que preparan el sistema digestivo para la ingesta de alimentos, como lo describió por primera vez Pavlov.
Las conexiones entre los estados mentales y fisiológicos se manifiestan en la medicina moderna en la correlación epidemiológica entre los niveles elevados de estrés y la aparición de enfermedades o en la mejora del estado fisiológico en pacientes que reciben una píldora placebo.
Las intervenciones dirigidas a la conexión cerebro-cuerpo, como las prácticas de respiración, las técnicas de meditación y relajación y el ejercicio, están respaldadas por un conjunto emergente de evidencia correlativa que beneficia el tratamiento de las necesidades emocionales, psicológicas y cognitivas de un paciente. Sin embargo, no entendemos cómo funcionan estas terapias, lo que nos deja con un desafío significativo para descubrir los mecanismos subyacentes de la comunicación cerebro-cuerpo en la salud y la enfermedad.
La segregación entre el cerebro y el cuerpo que ha llegado a dominar la medicina moderna está motivada por la necesidad de comprender los mecanismos causales de los fenómenos fisiológicos. Requirió diseccionar la base de cada sistema fisiológico de forma aislada para obtener una comprensión detallada de sus componentes.
Esto contrasta con las prácticas médicas orientales, que se rigen por una percepción integrada de mente-cuerpo.
Sin embargo, la ciencia y la medicina modernas han llegado a un punto en el que la evidencia emergente en campos que van desde la inmunología, la reproducción, las enfermedades cardiovasculares, la microbiología y otros resalta la relevancia de las interconexiones entre estos sistemas.
Al tratar de reunir nuestra comprensión del cerebro y el cuerpo, la ciencia ha proporcionado evidencia de interacciones entre el sistema nervioso y otros sistemas fisiológicos en múltiples niveles de interacción. Definiremos estas interacciones como un conjunto de bucles jerárquicos: local, reflexivo y central (Figura 1).
Esta segregación conceptual, aunque artificial, nos permitirá hablar de cada bucle con su propio conjunto de parámetros y regulación específica y definir cómo se sincronizan en el esquema general de integración cerebro-cuerpo.
Finalmente, ejemplificaremos cómo estos conceptos se aplican a la interacción del cerebro con un sistema periférico esencial, el sistema inmunológico, y al concepto de inmunocepción.
Entradas al sistema nervioso
El sistema nervioso detecta y evalúa constantemente el estado fisiológico del cuerpo. El cerebro recibe información en dos formas principales: moléculas solubles que llegan a los órganos circunventriculares (OCV) y otros límites cerebrales (ver Cuadro 1), y neuronas sensoriales, que sirven como vías de información directa desde el cuerpo (Figura 2).
Las neuronas sensoriales incluyen los nervios craneales, con los nervios vago y glosofaríngeo proporcionando inervación dominante de los órganos en el abdomen y el tórax, así como los nervios espinales de los ganglios de la raíz dorsal (GRD).
El nervio vago inerva colectivamente una variedad de órganos en el intestino, así como las vías respiratorias (pulmones, tráquea y laringe), la vasculatura (corazón, arterias) y otros sitios abdominales y torácicos.
Las neuronas sensoriales vagales incluyen sensores de primer orden que detectan directamente los estímulos, así como neuronas de segundo orden que reciben información de células centinela aguas arriba, como las células enteroendocrinas en el intestino, las células glómicas en la vasculatura, los cuerpos neuroepiteliales en el pulmón, las células gustativas en la laringe y las células inmunes.
Algunas son neuronas quimiosensoriales, especializadas en detectar condiciones hipóxicas o hipercápnicas, la ingestión de nutrientes o toxinas que inducen náuseas, la inhalación de ciertos irritantes que inducen tos o la infección por patógenos que causan enfermedades.
Otras son neuronas mecanosensoriales que detectan cambios en la presión arterial o el volumen sanguíneo, el cierre de las vías respiratorias y el estiramiento de órganos como los pulmones, el estómago, el corazón, el esófago y el intestino.
Los atlas unicelulares de neuronas sensoriales vagales revelaron una increíble diversidad celular, con docenas de tipos celulares distintos, mucho más que el número de reflejos vagales conocidos.
Además, los enfoques de mapeo genético y anatómico revelaron muchas morfologías terminales vagales con propiedades sensoriales desconocidas. Por lo tanto, existen capacidades adicionales del nervio vago que esperan ser caracterizadas.
Los axones vagales ingresan al cerebro de manera bilateral a través de los agujeros yugulares, y los del ganglio vagal más grande (el ganglio nodoso) se dirigen al tronco encefálico en el núcleo del tracto solitario (NTS), y algunos también se proyectan al área postrema (AP).
Las neuronas vagales del ganglio yugular, en cambio, se dirigen al tracto trigémino espinal. Una organización topográfica de la entrada sensorial visceral surge en el NTS a partir de representaciones desordenadas en los ganglios periféricos, y generalmente se mantiene en núcleos de orden superior, como los núcleos viscerosensoriales del tálamo y la corteza insular (CI).
Las neuronas DRG que inervan los órganos internos son aún menos conocidas.
Se sabe que las neuronas DRG detectan estímulos asociados con sensaciones de tacto, propiocepción (movimiento y ubicación de los músculos del cuerpo), nocicepción (dolor y picazón) y temperatura y envían entradas axónicas al asta dorsal de la médula espinal.
Luego, las señales se transmiten a través de vías espinotalámicas-corticales, donde hacen sinapsis con neuronas de orden superior.
La transcriptómica de células individuales identificó 17 tipos distintos de neuronas DRG de ratón, la mayoría de las cuales se conservan en humanos. Muchos tipos de neuronas responden a estímulos clásicos asociados con el tacto, el calor, el frío y el picor, mientras que las funciones de otras aún no se comprenden por completo.
Además de sus funciones clásicas en la somatosensibilidad, algunas también inervan órganos internos, incluida la vejiga, el colon, el corazón y el bazo.
Aun así, la diversidad de tipos de neuronas somatosensoriales involucradas en las representaciones viscerales, así como sus funciones, propiedades de respuesta y mecanismos de señalización, siguen siendo en gran medida desconocidos. Además, carecemos de estudios funcionales para comprender la división del trabajo entre las vías sensoriales de los nervios craneales, los nervios espinales y las OVC.
Salidas del sistema nervioso
A medida que el cerebro recibe información sensorial, la comunicación con el cuerpo se produce a través de vías humorales y neuronales importantes.
El sistema endocrino secreta hormonas en el torrente sanguíneo, mientras que el sistema nervioso somático controla el movimiento muscular voluntario y el sistema nervioso autónomo regula una variedad de funciones de los órganos internos, en las que nos centraremos aquí.
El sistema nervioso autónomo se divide en dos programas principales: los sistemas simpático y parasimpático. El sistema nervioso simpático es ampliamente reconocido por desencadenar la respuesta de “lucha o huida”, un término acuñado por Walter B.
Cannon a principios del siglo XX para describir una serie de ajustes fisiológicos rápidos y poderosos para preparar al cuerpo para enfrentar o escapar de amenazas urgentes. Por el contrario, el sistema nervioso parasimpático a menudo se asocia con el estado de “descanso y digestión”, que respalda las funciones corporales esenciales durante los períodos más tranquilos.
El sistema nervioso autónomo no sólo ajusta los procesos fisiológicos durante los estados emocionales y las conductas, sino que también es parte integral de nuestra vida diaria para mantener la homeostasis, es decir, garantizar la constancia de la fisiología de los órganos en medio de condiciones internas y externas en constante cambio.
Los sistemas nerviosos simpático y parasimpático suelen ser socios en la misma danza, con movimientos opuestos pero coordinados que mantienen un delicado equilibrio fisiológico.
El reflejo barorreceptor ejemplifica esta coordinación, asegurando la estabilización en tiempo real del sistema cardiovascular.
Las neuronas sensoriales barorreceptoras alertan al cerebro sobre los cambios en la presión arterial a través de la detección dependiente de PIEZO de la distensión arterial, lo que desencadena respuestas que ajustan la frecuencia cardíaca y la resistencia vascular mediante la activación del flujo parasimpático y la desconexión simultánea del flujo simpático.
Estos sistemas exhiben una sensibilidad dinámica, con circuitos centrales que se adaptan durante estados fisiológicos como el ejercicio.
Se han descrito funciones antagónicas similares de los sistemas simpático y parasimpático en todos los sistemas fisiológicos, desde la respiración hasta la digestión.
La comprensión de este rasgo distintivo del yin-yang de la comunicación cerebro-cuerpo en el contexto del sistema inmunológico y si los sistemas realmente tienen papeles opuestos se ha convertido en un área emergente de investigación.
El flujo autónomo implica un relé característico de dos neuronas, con neuronas preganglionares en el sistema nervioso central y neuronas posganglionares típicamente en los ganglios periféricos.
La neurona preganglionar tiene un axón motor que se dirige a los ganglios periféricos en el cuerpo, y la neurona posganglionar transmite comandos motores descendentes directamente a un órgano objetivo (Figura 2). Algunas neuronas preganglionares simpáticas también se dirigen a las células productoras de hormonas de la médula suprarrenal.
Las neuronas preganglionares simpáticas están situadas en los segmentos torácico y lumbar superior de la médula espinal, con ganglios simpáticos que comprenden la cadena simpática adyacente a las vértebras o ganglios simpáticos prevertebrales.
Las neuronas preganglionares simpáticas liberan acetilcolina, que actúa sobre los receptores nicotínicos para excitar las neuronas posganglionares o las células cromafines suprarrenales. Las neuronas posganglionares suelen liberar noradrenalina o, en casos excepcionales, acetilcolina y otras moléculas secretadas para regular funciones tisulares específicas.
Las células cromafines suprarrenales, por otro lado, secretan directamente catecolaminas como la epinefrina y la noradrenalina en el torrente sanguíneo, lo que influye de manera más amplia en la función orgánica.
Las respuestas celulares a la noradrenalina dependen notablemente de la dosis y están influidas por la eficiencia de la perfusión en los sitios receptores, lo que significa que los nervios que inervan objetivos específicos pueden crear concentraciones locales más altas de noradrenalina y desencadenar reacciones distintas en comparación con la noradrenalina sistémica.
En cambio, las neuronas preganglionares parasimpáticas residen directamente en el tronco encefálico, en los núcleos motores asociados con los nervios craneales (III, VII, IX y X) o en los segmentos sacros de la médula espinal.
Las neuronas parasimpáticas posganglionares se encuentran cerca o dentro de los órganos diana; por ejemplo, las neuronas parasimpáticas posganglionares en el intestino son parte del sistema nervioso entérico. La acetilcolina es el neurotransmisor principal utilizado tanto en las sinapsis preganglionares como en las posganglionares del sistema parasimpático. Las neuronas periféricas (parasimpáticas y simpáticas) a veces pueden coliberar neuropéptidos u óxido nítrico junto con aminas.
Estudios recientes que utilizan la secuenciación de RNA de células individuales han revelado una sorprendente diversidad dentro de los sistemas simpático y parasimpático, desafiando la antigua visión de estos sistemas como proveedores de respuestas uniformes de «todo o nada».
Los atlas celulares han proporcionado marcadores que permiten el desarrollo de herramientas genéticas para el mapeo selectivo y el control de neuronas definidas molecularmente, revelando que la diversidad transcripcional probablemente subyace a la diversidad funcional.
Por ejemplo, el análisis transcriptómico ha revelado una diversidad de neuronas preganglionares vagales, con al menos siete subtipos de neuronas dentro del núcleo motor dorsal del vago (DMV) y un grupo más pequeño dentro del núcleo ambiguo (nAmb).
Estos subtipos de neuronas exhiben patrones de conectividad distintos dentro del cuerpo, y los primeros estudios sugieren una división funcional del trabajo. Diferentes subtipos neuronales dentro del nAmb median el reflejo barorreceptor, el reflejo de inmersión y el control motor sobre el esófago. Cada tipo de neurona ejerce potencialmente un control fisiológico diferencial y matizado en lugar de una respuesta singular de todo o nada de descanso y digestión.
En conjunto, estos hallazgos indican que la diversidad transcripcional es un principio organizativo crucial en las neuronas preganglionares parasimpáticas, y que cada tipo de neurona asume un patrón de proyección único y una función específica.
Enfoques similares están empezando a arrojar luz sobre la diversidad transcripcional del sistema nervioso simpático, corroborando estudios tempranos de histología y electrofisiología que observaron diferencias en el tamaño del soma, la morfología de las dendritas, la propiedad de respuesta y la expresión de neuropéptidos. Los análisis de células individuales identificaron 16 tipos de neuronas preganglionares colinérgicas que comprenden los flujos de salida toracolumbares y sacros, y de cinco a siete subtipos en los ganglios cervicales superiores, estrellados y torácicos.
Estos estudios revelan la expresión de numerosos genes que codifican neuropéptidos y receptores hormonales, lo que sugiere mecanismos de comunicación y mecanismos moduladores más complejos más allá de la transmisión aminérgica canónica.
Además, estos ricos conjuntos de datos permiten una oportunidad sin precedentes para estudiar los intrincados mecanismos de transducción de señales y modulación neuronal en el sistema nervioso simpático y potencialmente revelarán nuevas características y funciones organizativas.
El acceso genético a las neuronas autónomas definidas molecularmente proporcionará una hoja de ruta para vincular perfiles transcripcionales, características morfológicas, patrones de proyección, propiedades de respuesta y funciones.
Las herramientas farmacológicas que se dirigen a poblaciones neuronales específicas pueden proporcionar un control personalizado de la fisiología y nuevas oportunidades terapéuticas para el ajuste selectivo del tono autónomo.
Esta diversidad neuronal también pone de relieve mecanismos precisos y complejos durante el desarrollo neuronal para garantizar un cableado y una función adecuados, así como cuestiones interesantes sobre el desarrollo y la mecánica que esperan una mayor investigación.
Regulación neuronal a través de jerarquías: la interconexión de la regulación local, reflexiva y central
La intrincada y entrelazada arquitectura del sistema nervioso se caracteriza por una serie de controles jerárquicos de la fisiología corporal que, como se describió en la sección anterior, conectan el sistema nervioso periférico con el central.
Esta compleja red es un continuo, afinado mediante la integración de niveles reguladores locales, reflexivos y centrales para coordinar las interacciones del cuerpo con su entorno y promover la homeostasis tanto en una escala de tiempo corta como larga.
Control local
Las neuronas sensoriales periféricas están profundamente arraigadas en los tejidos. Además de transmitir información sensorial al sistema nervioso central, las neuronas sensoriales y/o sus socios de comunicación, como las células enteroendocrinas en el intestino, pueden en algunos casos tener funciones más locales, liberando péptidos que provocan efectos fisiológicos directos en los tejidos periféricos.
Sin embargo, debe notarse que la existencia de respuestas locales no excluye el enrutamiento de información relevante a través del cerebro.
Estos efectos locales de las neuronas sensoriales se demostraron en el contexto de la inmunidad. Las neuronas sensoriales periféricas inervan tejidos habitados por células inmunes.
Estas neuronas pueden detectar directamente la presencia de patógenos o cambios en la actividad inmune a través de receptores de citocinas o receptores de reconocimiento de patrones que detectan componentes derivados de patógenos.
Además de transmitir esta información sensorial relacionada con el sistema inmunológico al sistema nervioso central, estas neuronas sensoriales también pueden modular localmente la respuesta inmune. Pueden secretar factores reguladores como el péptido relacionado con el gen de la calcitonina (CGRP), la sustancia P (SP) y el péptido intestinal vasoactivo (VIP).
En consecuencia, las neuronas sensoriales estuvieron implicadas en la supresión de la inflamación, su impulso y la mediación de la resistencia a las infecciones.
Las interacciones locales entre las neuronas somatosensoriales y las células inmunes son particularmente evidentes en los mecanismos nociceptivos, donde las células inmunes liberan mediadores inflamatorios que sensibilizan o activan las neuronas sensoriales, contribuyendo al inicio y mantenimiento del dolor y la conducta de enfermedad.
Los mastocitos, los neutrófilos y los macrófagos contribuyen a esta interacción al desempeñar papeles discretos en la afectación de las neuronas, mediando el dolor y la picazón.
Estos mecanismos locales son evidentes y más complicados en entornos clínicos, donde el daño a los nervios se ha asociado con la mejora de la psoriasis, mientras que una mutación genética que resulta en la falta de neuronas somatosensoriales se asocia con más infecciones bacterianas.
Sin embargo, es importante señalar que algunos de estos efectos también pueden producirse en los niveles reflexivo y regulador central.
La conexión entre el dolor y la inflamación cumple una función adaptativa importante en todos estos niveles. La sensibilización al dolor conduce a una modificación del comportamiento para proteger las zonas afectadas y evitar la presión sobre un punto inflamado.
Según esta línea de razonamiento, se puede esperar que las citocinas proinflamatorias exacerben el dolor mientras que las citocinas antiinflamatorias ayudan a aliviarlo. Sin embargo, los programas de actividad de las neuronas sensoriales no son tan discretos, y las variaciones en los patógenos activadores (p. ej., bacterias frente a virus), el tejido afectado, los tipos específicos de neuronas sensoriales implicadas y la condición predominante del tejido. Todo ello pone de relieve una importante laguna en nuestra comprensión de las interacciones locales entre el dolor y la inmunidad.
Otra laguna conceptual que pone de relieve la importancia de seguir investigando en esta dirección es la comprensión de por qué las neuronas sensoriales secretan mediadores inmunitarios a pesar de la presencia de otras células tisulares, como los subconjuntos epiteliales, que son capaces de cumplir esta función. Una posibilidad es que estas neuronas sensoriales locales posean cierto nivel de capacidad integradora que se manifieste en sus efectos diferenciales sobre la respuesta inmunitaria local.
Control reflexivo
Más allá de la respuesta sensorial local, una vía seguida de una actividad refleja, conocida como arco reflejo, generalmente involucra una neurona sensorial que detecta el estímulo y una neurona motora que lleva a cabo la respuesta (Figura 3).
Sin embargo, las actividades reflejas pueden involucrar vías más complejas, incluidos relés neuronales adicionales.
Este procesamiento adicional de información dentro de la médula espinal o el tronco encefálico puede conducir a respuestas más matizadas basadas en otros estímulos sensoriales o el estado fisiológico del tejido u organismo.
Los circuitos reflejos están muy involucrados en la regulación de la homeostasis, el delicado equilibrio de mantener las condiciones fisiológicas dentro de un punto de ajuste estrecho. Este punto de ajuste abarca constantes como la temperatura corporal central, la presión arterial y los niveles sistémicos de azúcar, que pueden ser regulados en gran medida por arcos reflejos fisiológicos sin la participación de áreas cerebrales superiores.
Estos tipos de arcos reflejos clásicos son sistemas reactivos que proporcionan un control directo de retroalimentación negativa al desencadenar acciones compensatorias estereotipadas cuando los parámetros fisiológicos se desvían de sus puntos de ajuste predefinidos.
Los arcos reflejos más complejos también permiten cambios dinámicos en los puntos de ajuste fisiológicos; por ejemplo, el ejercicio amortigua el reflejo barorreceptor para permitir que la frecuencia cardíaca y la presión arterial permanezcan elevadas según sea necesario.
Un ejemplo de una respuesta refleja en el eje neuroinmune es el reflejo inflamatorio (Figura 3). Inicialmente se observó que la estimulación eléctrica del nervio vago amortigua la respuesta inmunitaria sistémica al choque de endotoxinas (los mediadores específicos que activan esta respuesta aún no se han dilucidado por completo).
Se propuso que las neuronas motoras vagales inervan las neuronas posganglionares que se proyectan hacia el bazo y que se encuentran en los ganglios mesentéricos superiores celíacos de los ganglios prevertebrales simpáticos. Las neuronas posganglionares liberan entonces noradrenalina en el bazo, que envía señales a las células T colinérgicas a través de receptores β2-adrenérgicos.
La acetilcolina derivada de las células T actúa posteriormente a través de un receptor nicotínico (α7nAChR) en los macrófagos, suprimiendo la respuesta de las citocinas inflamatorias. Este mecanismo neuronal facilita una respuesta rápida y sistémica esencial para la supervivencia.
Esto es importante porque las células inmunes se comunican a través de señales químicas dispersas, lo que da como resultado una respuesta más lenta y localizada.
Esto es crucial para regular cuidadosamente las reacciones inmunes. Sin embargo, cuando se requiere una respuesta más rápida y sistémica (por ejemplo, sepsis), el sistema nervioso puede tender un puente. Estos son programas cableados que son cruciales para la supervivencia. Por ejemplo, las neuronas del NTS caudal responden indirectamente a las citocinas secretadas durante la inflamación y trabajan para suprimir la inflamación.
Se ha demostrado que otro componente de la inflamación, la conducta de enfermedad, también está mediada por neuronas en el NTS y el AP. El AP es activado directamente por ciertas citocinas, como GDF15, y media conductas relacionadas con la enfermedad, como las náuseas. Si bien estas conductas también involucran estructuras cerebrales superiores y requieren un procesamiento complejo por parte del cerebro, se han demostrado bucles reflejos directos entre las señales inmunes que llegan al AP y las respuestas autónomas (Figura 3).
Se ha informado de una variación intrigante de los reflejos neuroinmunes en estudios que involucran estimulación con electroacupuntura (ES).
Estos estudios descubrieron que la estimulación de subconjuntos específicos de neuronas sensoriales periféricas en puntos de acupuntura puede producir una activación vagal-suprarrenal, que induce un efecto antiinflamatorio (Figura 3).
Cabe destacar que un estudio demostró que esto depende de la intensidad: la estimulación electroencefalográfica de alta intensidad activa un mecanismo diferente a través del eje espinal-simpático, que puede impulsar la inflamación.
Estos hallazgos resaltan una brecha importante en este campo, lo que plantea preguntas sobre los posibles bucles de reflejos simpáticos. Además, subrayan nuestra comprensión incompleta de las interacciones entre los dos componentes del sistema nervioso autónomo. Una aplicación prometedora del reflejo inflamatorio es el uso de la estimulación del nervio vago (ENV) para reducir la inflamación en enfermedades como la enfermedad inflamatoria intestinal (EII), la pancreatitis, la lesión renal y la artritis reumatoide.
Cabe destacar que la ENV ha sido eficaz para calmar la inflamación intestinal al actuar directamente sobre células inmunitarias específicas en el intestino en lugar de a través del bazo o las células T. Sin embargo, la amplia activación de las neuronas motoras y sensoriales vagales por la ENV limita la generalización de este enfoque.
Una orientación más selectiva de poblaciones neuronales específicas podría mejorar la eficacia y limitar los efectos secundarios.
Es crucial comprender qué neuronas motoras específicas interactúan con el sistema inmunológico, junto con las vías sensoriales correspondientes de las que reciben información. Esta investigación plantea preguntas críticas sobre los beneficios de los circuitos neuronales antiinflamatorios y las implicaciones más amplias para las funciones gobernadas por reflejos similares. También destaca la comunicación entre estos bucles reguladores; si bien estas redes inician respuestas a nivel del tronco encefálico, dan como resultado un conjunto más complejo de comportamientos regulados por vías centrales e interoceptivas.
Regulación central e inmunocepción
Los niveles locales y reflexivos de control proporcionan una regulación reactiva rápida y directa de la fisiología corporal a través de programas de acción predefinidos.
Las áreas cerebrales de orden superior actúan de manera más adaptativa, sincronizando los cambios en los sistemas fisiológicos y escalas temporales, ajustando las funciones corporales en tiempo real durante la conducta e iniciando de manera proactiva acciones reguladoras centrales.
Integran información sobre el estado actual de los diferentes sistemas corporales y condiciones ambientales con programas seleccionados evolutivamente, experiencia previa y estado motivacional. Este procesamiento permite al cerebro anticipar estados futuros y ajustar las funciones corporales para satisfacer necesidades o desafíos entrantes.
Para lograr tales ajustes, las áreas cerebrales de orden superior ejercen un control de arriba hacia abajo de la fisiología, incluidas alteraciones temporales de los puntos de ajuste homeostáticos para adaptarse a los estados esperados, así como de los impulsos motivacionales y la conducta (Figura 1).
Por lo tanto, los circuitos centrales del sistema nervioso interoceptivo son esenciales para adaptar la fisiología corporal en entornos dinámicos (Figura 4). Las teorías emergentes proponen que la homeostasis adaptativa es central para la función cerebral y proporcionan modelos de trabajo para la interocepción y la regulación corporal.
Las áreas cerebrales interoceptivas integran la información visceral que asciende desde las aferencias vagales y espinales, pasando por el NTS, el núcleo parabranquial (PBN) y los núcleos talámicos interoceptivos, y finalmente alcanzando el IC posterior (pIC), la corteza cingulada anterior (ACC) y las cortezas somatosensoriales.
En paralelo, las moléculas transportadas por la sangre son detectadas por los CVO y otras regiones limítrofes (Cuadro 1), que también transmiten información en última instancia a las regiones corticales, incluyendo el IC y el ACC.
Los sitios corticales que reciben información interoceptiva están interconectados con regiones corticales visceromotoras, como el IC anterior (aIC), el ACC, las cortezas prefrontal ventromedial y orbitofrontal, que se cree que median el control homeostático adaptativo.
En este nivel, se realiza una integración multisensorial más compleja, así como el procesamiento en el contexto de la experiencia previa, los impulsos motivacionales, la emoción y la cognición. Como resultado, se cree que estas áreas cerebrales calculan predicciones interoceptivas, en base a las cuales se generan comandos coordinados autónomos, conductuales motivados, neuroendocrinos e inmunológicos para asegurar una adaptación contextual óptima de la fisiología del organismo.
Las predicciones visceromotoras coordinadas se transmiten a las estructuras subcorticales que reclutan las reacciones adaptativas, como el hipotálamo, la amígdala central (CeA), el núcleo del lecho de la estría terminal (BNST), el nervio periacueductal (PAG), el núcleo motor autónomo y los núcleos motores autónomos, incluyendo el DMV y el bulbo raquídeo ventrolateral (VLM) (Figura 4). Las cortezas motoras, incluyendo M1, M2 y el área motora suplementaria, también contribuyen a través del control del músculo estriatal y la modulación simpática.
Si bien las vías descritas describen un eje general para la interocepción y la regulación central, las regiones corticales y subcorticales involucradas están altamente interconectadas. La mayoría de estas estructuras procesan información interoceptiva y actúan como centros visceromotores, formando bucles de control jerárquicos con múltiples mecanismos de retroalimentación y avance entre los diferentes niveles de control (Figuras 1 y 4).
El NTS y el PBN tienen conexiones bidireccionales directas con los núcleos hipotalámicos, como el núcleo hipotalámico paraventricular (PVN) y el área hipotalámica lateral (LHA), el CeA, BNST y PAG. Estas proyecciones están involucradas, por ejemplo, en la modulación de los estados emocionales y las conductas motivadas durante la inflamación y el dolor, o en la regulación de la actividad inmune sistémica en respuesta a señales proinflamatorias.
El mantenimiento del equilibrio de líquidos sirve como un excelente ejemplo para conceptualizar cómo el cerebro coordina el control reactivo con la regulación anticipatoria, impulsando cambios adaptativos al procesar la información sensorial interna.
Cuando el cuerpo detecta cambios en el volumen sanguíneo, se recluta una cascada de acciones compensatorias para restaurar la homeostasis de los líquidos a través de la regulación negativa. bucles de retroalimentación.
Después de eventos como la deshidratación grave, las respuestas autónomas aseguran una presión arterial sustancial y la irrigación tisular acelerando la frecuencia cardíaca e induciendo vasoconstricción periférica, mientras que los ajustes hormonales preservan el volumen de líquido.
Diferentes brazos del sistema nervioso interoceptivo colaboran para producir estas respuestas complejas, incluidos los barorreceptores en el sistema cardiovascular, hormonas como la angiotensina II y sensores de osmolaridad en los CVO.
La deshidratación también activa neuronas específicas, promoviendo la percepción de la sed y motivando conductas de búsqueda y bebida de agua. Estas neuronas transmiten información indirectamente a las regiones anteriores de la corteza cingulada y el IC, importantes en la percepción de la sed y el impulso de estas conductas.
Es importante destacar que la anticipación de una mayor necesidad de agua, como durante el consumo de alimentos, o una menor necesidad de agua inmediatamente después de beber, puede ajustar la conducta y la fisiología.
Estos cambios ocurren antes de cambios mensurables en la osmolaridad sanguínea, el volumen sanguíneo o los niveles hormonales, lo que es coherente con el papel de los circuitos centrales en el control fisiológico y conductual de arriba hacia abajo.
Los perros salivantes de Pavlov proporcionan otro ejemplo clásico que ilustra una modulación anticipatoria similar del circuito central de los procesos corporales.
El CI ha sido reconocido desde hace mucho tiempo como la corteza visceral primaria, que recibe una fuerte entrada sensorial de múltiples sistemas corporales y regula activamente la fisiología. La evidencia acumulada apoya el papel del CI en la integración de entradas sensoriales internas y externas con información contextual anticipatoria, dando forma a representaciones interoceptivas y regulando la fisiología directa o indirectamente a través de cambios en la motivación y el comportamiento.
En los humanos, la experiencia de la intensidad del dolor térmico y el tacto afectivo activa el CI medio y el pIC, mientras que su anticipación contextual o evocada por señales activa el aIC. Las predicciones de los cambios en la respiración también modulan la actividad del aIC.
En roedores, neuronas «anticipatorias» similares en el CI responden a señales asociativas que señalan la aparición de estímulos sensoriales que afectan el estado fisiológico, como comida, agua o descarga eléctrica aversiva en el pie.
Se encontró que la actividad anticipatoria que señala la disponibilidad de comida o agua depende en gran medida de la necesidad del cuerpo. Esta prominencia dependiente de la necesidad de señales relevantes se transmite desde el hipotálamo a través del tálamo paraventricular y la amígdala basolateral, y se proyecta al CI.
La actividad anticipatoria del CI contribuye a guiar conductas motivadas que promueven la homeostasis y a controlar de manera adaptativa la fisiología, como durante los estados emocionales.
De hecho, las neuronas del CI que responden a señales de comida o agua son necesarias para las conductas motivadas que se exhiben durante la anticipación, como acercarse a la comida, o aumentar el vigor de la acción para recibir agua cuando se tiene sed.
Como ilustración del reclutamiento de cambios corporales adaptativos en el contexto de las emociones, las neuronas que se proyectan desde el pIC hasta el CeA son activas en contextos ansiogénicos e inducen un aumento en la frecuencia respiratoria al mismo tiempo que promueven la evitación o una conducta similar a la ansiedad.
Estos y otros estudios sugieren que las neuronas en el CI pueden codificar señales anticipatorias relacionadas con el estado interno, integrando estados de necesidad corporal y regulando estados emocionales y motivacionales junto con la fisiología corporal para formar una respuesta coordinada.
Es importante destacar que esta evidencia destaca cómo las emociones sirven como un mecanismo central adaptativo para ajustes directos e indirectos de la fisiología en contextos que son relevantes para la supervivencia.
A su vez, las reacciones corporales durante las respuestas emocionales influyen en la persistencia de los recuerdos emocionales.
Esta interacción bidireccional se considera cada vez más fundamental para mantener la homeostasis fisiológica y emocional.
El cerebro no sólo anticipa las necesidades y los estados fisiológicos, sino que los sincroniza a través de múltiples sistemas y a lo largo del tiempo.
La capacidad única del cerebro para controlar el tiempo lo convierte en un mecanismo de sincronización muy eficaz. Por ejemplo, nuestro ritmo circadiano sincroniza la movilización de células inmunitarias a lo largo del día.
Además, el crecimiento óseo y el movimiento de células madre hematopoiéticas dentro de la sangre y la médula ósea están programados para ocurrir durante la noche, sincronizados por la liberación de la hormona del crecimiento (GH) y controlados por la inervación simpática a la médula ósea.
Además de los ritmos circadianos que coordinan los procesos fisiológicos a lo largo del día, la percepción del tiempo también es parte de nuestros procesos interoceptivos, ya que anticipamos cuánto tiempo tomará un determinado proceso y orquestamos nuestro comportamiento y fisiología en consecuencia.
Se ha demostrado que la cicatrización de heridas varía con la percepción del tiempo más que con el tiempo real, lo que sugiere que la manipulación del reloj puede afectar las respuestas fisiológicas. De manera similar, en pacientes con diabetes tipo 2, los niveles de glucosa en sangre parecen responder mejor al tiempo percibido que al tiempo real.
Esto indica que el reloj interno del cerebro, el núcleo supraquiasmático (NSQ) del hipotálamo, puede sincronizar las funciones corporales con las señales ambientales o con los ritmos circadianos para evitar conflictos internos.
Curiosamente, también existen relojes circadianos periféricos que pueden mantener oscilaciones circadianas aisladas del NSQ, pero que, no obstante, dependen de las entradas centrales para la sincronización en todo el organismo.
La capacidad anticipatoria del cerebro en el contexto de la regulación inmunológica se manifiesta mediante conductas motivadas, como el apareamiento y la alimentación, que pueden aumentar potencialmente la exposición a patógenos.
Estas conductas involucran a las neuronas dopaminérgicas del área tegmental ventral (ATV), un área implicada en conductas motivadas.
De hecho, un estudio ha demostrado que la anticipación del apareamiento es suficiente para preparar el sistema inmunológico, específicamente un aumento en los niveles de interleucina (IL)-2, pero la inhibición de la actividad de la ATV elimina esta respuesta típica. Se ha demostrado que la activación directa de la ATV con DREADD mejora la actividad inmunológica contra las bacterias y el cáncer.
Es importante señalar que las manipulaciones artificiales de la ATV u otros componentes del sistema de recompensa con quimiogenética u optogenética están aisladas del contexto fisiológico, y se requiere un análisis más detallado de las proyecciones específicas.
Curiosamente, las expectativas positivas como la esperanza que implican la activación del sistema de recompensa se han asociado con la respuesta placebo y la mejora de las respuestas fisiológicas.
Sin embargo, el placebo es un fenómeno más complejo que también implica procesos de condicionamiento. De hecho, estudios de principios del siglo XX demostraron que el sistema inmunológico podía sufrir condicionamiento.
La exposición a un agente inmunoestimulante o supresor junto con un estímulo neutro (sacarina) puede inducir respuestas inmunológicas condicionadas al estímulo neutro solo. Varias áreas cerebrales, incluido el CI, estuvieron implicadas en este condicionamiento.
Recientemente, se demostró que el CI almacena una representación inmunológica en el cerebro. La reactivación de conjuntos neuronales en el CI que estaban activos durante condiciones inflamatorias resultó en un recuerdo del estado inflamatorio, incluso en ausencia de un nuevo desafío inmunológico.
Se sugirió que estos efectos estaban mediados por neuronas del CI conectadas a órganos periféricos como el colon y el peritoneo a través del DMV y el VLM rostral, lo que respalda el papel del sistema nervioso autónomo en la mediación de estos efectos.
Estos hallazgos sugieren que el cerebro puede inducir reacciones inmunológicas específicas, que pueden haber evolucionado como un mecanismo para abordar de manera eficiente los desafíos ambientales que es probable que se repitan.
Este fenómeno podría compararse con la medida anticipatoria del cuerpo contra futuras agresiones similares al encuentro original.
Esta “memoria inmunológica” dentro del cerebro, específicamente en el CI, puede crear un mecanismo de defensa rápido y eficiente antes de que el cuerpo sea desafiado. Por ejemplo, puede preparar a las células inmunes intestinales cuando se preparan para beber de una fuente de agua que previamente causó una infección.
Sin embargo, tales “respuestas de memoria” pueden volverse inadaptativas en pacientes autoinmunes al desencadenar episodios inflamatorios en respuesta a estímulos específicos. Estudios recientes sobre alergias revelaron que las conductas de evitación inducidas cuando se encuentra un alérgeno establecido son el resultado de interacciones neuroinmunes.
Estos estudios muestran que los mastocitos conectados a anticuerpos IgE específicos del alérgeno secretan mediadores que activan el NTS, PBN y CeA. Además, en casos de EII, los estudios de imágenes muestran una actividad alterada en áreas cerebrales clave involucradas en la interocepción, lo que potencialmente induce brotes inflamatorios en respuesta a desencadenantes estresantes.
De hecho, la manipulación de áreas clave del cerebro mediante estimulación cerebral profunda (ECP) o la reactivación de neuronas NTS activadas por citocinas tiene potentes efectos inmunomoduladores y endocrinos.
Al comprender estos mecanismos subyacentes, podemos desarrollar estrategias terapéuticas más efectivas y específicas que aprovechen la interfaz neuroinmune.
Además, estos hallazgos enfatizan el papel del cerebro como sincronizador y regulador de la fisiología corporal, ya que estas estimulaciones específicas tuvieron efectos locales en la respuesta inmunitaria.
Otro aspecto que destaca el componente anticipatorio de la conexión neuroinmune es el estrés. La respuesta al estrés predice el daño potencial al organismo e influye en la distribución y actividad de los leucocitos.
Las células inmunitarias pueden movilizarse rápidamente a la sangre en respuesta al estrés agudo, lo que prepara al sistema inmunitario para cualquier desafío potencial.
Curiosamente, diferentes factores estresantes agudos involucran áreas cerebrales distintas, que inducen diversos efectos en el sistema inmunitario. Por ejemplo, los circuitos motores pueden provocar una rápida movilización de neutrófilos desde la médula ósea a los tejidos, mediada por quimiocinas que atraen neutrófilos desde el músculo esquelético.
Por el contrario, el PVN regula el movimiento de monocitos y linfocitos desde los órganos linfoides secundarios de regreso a la médula ósea a través de la señalización de glucocorticoides. De manera similar, las neuronas en CeA y PVN que expresan la hormona liberadora de corticotropina (CRH) están conectadas al nervio esplénico y mejoran de manera autónoma las respuestas humorales.
Estos cambios de leucocitos inducidos por el estrés también están asociados con susceptibilidades alteradas a las enfermedades.
Sin embargo, representan una conexión esencial entre el cerebro y el sistema inmunológico para preparar al sistema inmunológico para un desafío futuro y son parte del proceso continuo de inmunocepción.
La inmunocepción, la representación del cerebro del estado inmunológico del organismo, al igual que otros aspectos de la interocepción, es bidireccional y dinámica. Está compuesta por componentes locales, reflejos y centrales que se retroalimentan entre sí.
El sistema inmunológico, altamente diverso y profundamente arraigado, monitorea constantemente el entorno local. Cuando detecta un daño, requiere la movilización de las células inmunes a los sitios objetivo, facilitada por cambios en el comportamiento, el metabolismo y el flujo sanguíneo local.
Estos cambios son orquestados por citocinas y mediadores inmunes necesarios para la comunicación entre células inmunes, pero también con las neuronas sensoriales incrustadas en estos tejidos. El sistema nervioso puede entonces alterar el flujo sanguíneo al sitio objetivo. Por ejemplo, las fibras simpáticas que rodean los vasos sanguíneos pueden regular la permeabilidad vascular, influyendo en la extravasación de células inmunitarias.
Luego, a nivel reflejo, las áreas del tronco encefálico pueden volverse sensibles a estas citocinas, iniciando respuestas correctivas que pueden aumentar o disminuir la respuesta inmunitaria.
Sin embargo, esta respuesta refleja puede no ser suficiente para satisfacer todas las necesidades del organismo, incluidos los cambios en los programas metabólicos y los comportamientos relevantes para apoyarlos. Por ejemplo, varios estados inflamatorios deben alinearse con programas metabólicos específicos para activar mecanismos de protección tisular.
De hecho, la supervivencia a la inflamación viral depende del funcionamiento de las vías de utilización de glucosa, mientras que la supervivencia de la inflamación bacteriana depende de combustibles alternativos y procesos cetogénicos, que requieren cambios en la conducta alimentaria.
Por lo tanto, el sistema inmunológico necesita la integración con el sistema nervioso para coordinar los complejos cambios fisiológicos y conductuales necesarios para la supervivencia del organismo.
Un ejemplo intrigante es la caquexia, que es evidente en algunas formas de cáncer. Se ha demostrado que este síndrome de desgaste severo está mediado en parte por la respuesta a la detección de IL-6 circulante por parte del AP.
Esto conduce a la activación de áreas interconectadas, como el NTS, PBN, PVN, CeA, BNST y el núcleo hipotalámico arqueado, que, en conjunto, pueden inducir el complejo conjunto de cambios conductuales y metabólicos evidentes en la caquexia.
La caquexia no está clara funcionalmente porque es perjudicial para la supervivencia, pero puede representar un proceso adaptativo que altera los programas metabólicos como un intento de supervivencia.
Estos ejemplos destacan que la interacción entre el sistema nervioso y el sistema inmunológico se produce a través de múltiples niveles de interacción.
Cada nivel procesa diferentes entradas e integra otra información disponible, infundiendo al sistema inmunológico capacidades adicionales y mejorando la respuesta fisiológica general.
Estas capacidades incluyen el monitoreo continuo, las funciones predictivas y la integración de datos complejos, facultades que amplían en gran medida la capacidad autónoma del sistema inmunológico. Sin embargo, también está claro que estamos apenas en las primeras etapas de la comprensión de estas interacciones.
Apenas estamos empezando a descubrir cómo el cerebro forma las representaciones inmunitarias y qué información recoge para formar esas representaciones (citocinas, actividad inmunitaria, cambios en los tejidos afectados, información metabólica, etc.).
Sin embargo, este conocimiento nos permitirá comprender mejor el potencial del cerebro para modular los procesos inmunitarios y puede conducir a nuevas estrategias terapéuticas guiadas por los principios reguladores básicos revelados por el sistema nervioso.
Observaciones finales
El sistema nervioso impregna todos los órganos y tejidos del cuerpo, proporcionando una capacidad extraordinaria para integrar información, generar respuestas rápidas y anticipar experiencias específicas. Este intrincado sistema permite que el organismo funcione de manera cohesiva.
A pesar de nuestro creciente conocimiento, todavía estamos en el umbral de la comprensión de los complejos mecanismos que intervienen. Las investigaciones en curso prometen revelar nuevas facetas de la fisiología y pueden proporcionar información sobre enfermedades que a menudo se consideran psicosomáticas.
Es un error común trivializar estas enfermedades diciendo que “todo está en la cabeza”, pero cada vez está más claro que las actividades del cerebro resuenan en todo el organismo.
Lo que sucede dentro de los confines neuronales tiene repercusiones sistémicas, lo que nos desafía a ampliar nuestra perspectiva sobre la salud y la enfermedad.
Cuadro 1
Órganos circunventriculares: detección de hormonas y citocinas en el cerebro
El cerebro es casi impenetrable, protegido de cerca por la restrictiva barrera hematoencefálica. Las células y las macromoléculas grandes transportadas por la sangre se excluyen intencionalmente del cerebro para protegerlo de infecciones y daños.
Sin embargo, hay información valiosa en el torrente sanguíneo en forma de hormonas y citocinas que pueden proporcionar información sobre el estado fisiológico interno.
El cerebro tiene estructuras especializadas llamadas CVO con capilares fenestrados y una barrera hematoencefálica reducida, donde se puede detectar la presencia de sustancias químicas transportadas por la sangre.
El área postrema es un CVO que actúa como un punto caliente para las interacciones neuroinmunes. Las citocinas como el factor de diferenciación del crecimiento 15 (GDF15) desencadenan respuestas del área postrema (AP), lo que provoca náuseas y mareos, así como cambios autonómicos e inmunológicos.
Las citocinas pueden afectar la actividad cerebral al interactuar directamente con las neuronas, la glía y/o las células ependimarias.
Otro ejemplo es la hormona leptina de los adipocitos, que puede acceder a las neuronas del hipotálamo para controlar la conducta alimentaria. La secuenciación de células individuales ha revelado una diversidad de neuronas sensoriales en los CVO, y se necesitan estudios adicionales para comprender la biología de muchas de estas neuronas sensoriales residentes en el cerebro y sus funciones en la comunicación cuerpo-cerebro.
Los CVO secretores son sitios de liberación de neurohormonas que controlan la fisiología corporal e incluyen el órgano subcomisural (OCS), la glándula pituitaria, la eminencia media y la glándula pineal. El plexo coroideo produce líquido cefalorraquídeo (LCR), pero, notablemente, carece de neuronas.
Es crucial para la modulación neurohumoral al regular el intercambio de moléculas entre la sangre y el LCR, secretando LCR y transportando hormonas, citocinas y nutrientes. También sirve como una interfaz inmunológica, produciendo moléculas de señalización que modulan las respuestas inmunitarias dentro del sistema nervioso central.
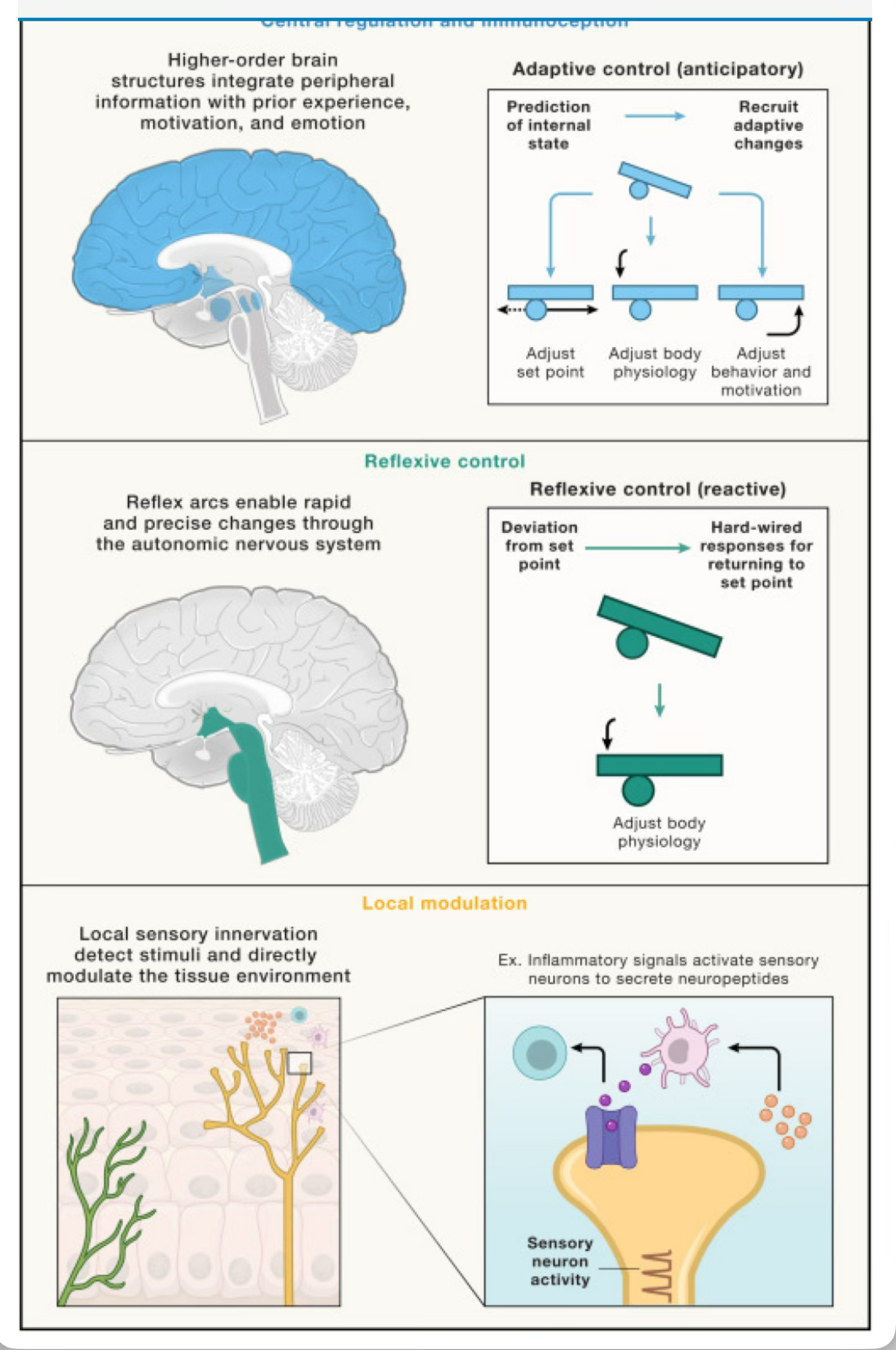
Figura 1.
El sistema nervioso se comunica con todos los sistemas fisiológicos del cuerpo a través de múltiples niveles interconectados.
Estos niveles forman bucles de control, en los que los niveles superiores regulan a los inferiores para lograr un control corporal adaptativo. Arriba: la regulación adaptativa central y la inmunocepción involucran estructuras cerebrales de orden superior que integran información interoceptiva con datos sensoriales externos, experiencias pasadas, impulsos motivacionales y emociones para formar una representación compleja.
Esta integración permite la modulación adaptativa del estado fisiológico interno, incluido el del sistema inmunológico, en diferentes contextos y escalas temporales, lo que permite la regulación prospectiva y dirigida a objetivos de la fisiología.
Esta regulación incluye el ajuste de los puntos de ajuste homeostáticos y la modulación de la fisiología corporal directa e indirectamente a través de ajustes en la motivación y el comportamiento.
El control adaptativo está guiado por regiones corticales (azul más oscuro) como el aIC, ACC, vmPFC y OFC, mientras que las regiones subcorticales (azul más claro) como CeA, BNST, hipotálamo, VS, PAG y PBN implementan los ajustes integrados en fisiología, motivación y comportamiento.
Centro: el control reflexivo es un sistema rápido y reactivo que se integra en sitios subcorticales (verde), como el hipotálamo o el NTS y el AP en el tronco encefálico. Aquí, la información del estado corporal actual se compara con puntos de ajuste homeostáticos predefinidos y, si se detecta una desviación, las respuestas programadas regulan la fisiología para volver a su punto de ajuste, como durante la inflamación. Los nervios autónomos, incluidas las ramas simpática y parasimpática, llevan instrucciones del cerebro y ejercen efectos diferenciales sobre la inflamación.
Abajo: la modulación local ocurre de manera bidireccional entre las neuronas sensoriales que inervan los sitios periféricos y las células locales, incluidas las células inmunes.
Estas interacciones influyen en la inflamación al modular la secreción de citocinas o neuropéptidos (lado derecho). aIC, corteza insular anterior; ACC, corteza cingulada anterior; vmPFC, corteza prefrontal ventromedial; OFC, corteza orbitofrontal; CeA, núcleo central de la amígdala; BNST, núcleo del lecho de la estría terminal; VS, estriado ventral; PAG, sustancia gris periacueductal; PBN, núcleo parabranquial; NTS, núcleo del tracto solitario; AP, área postrema.
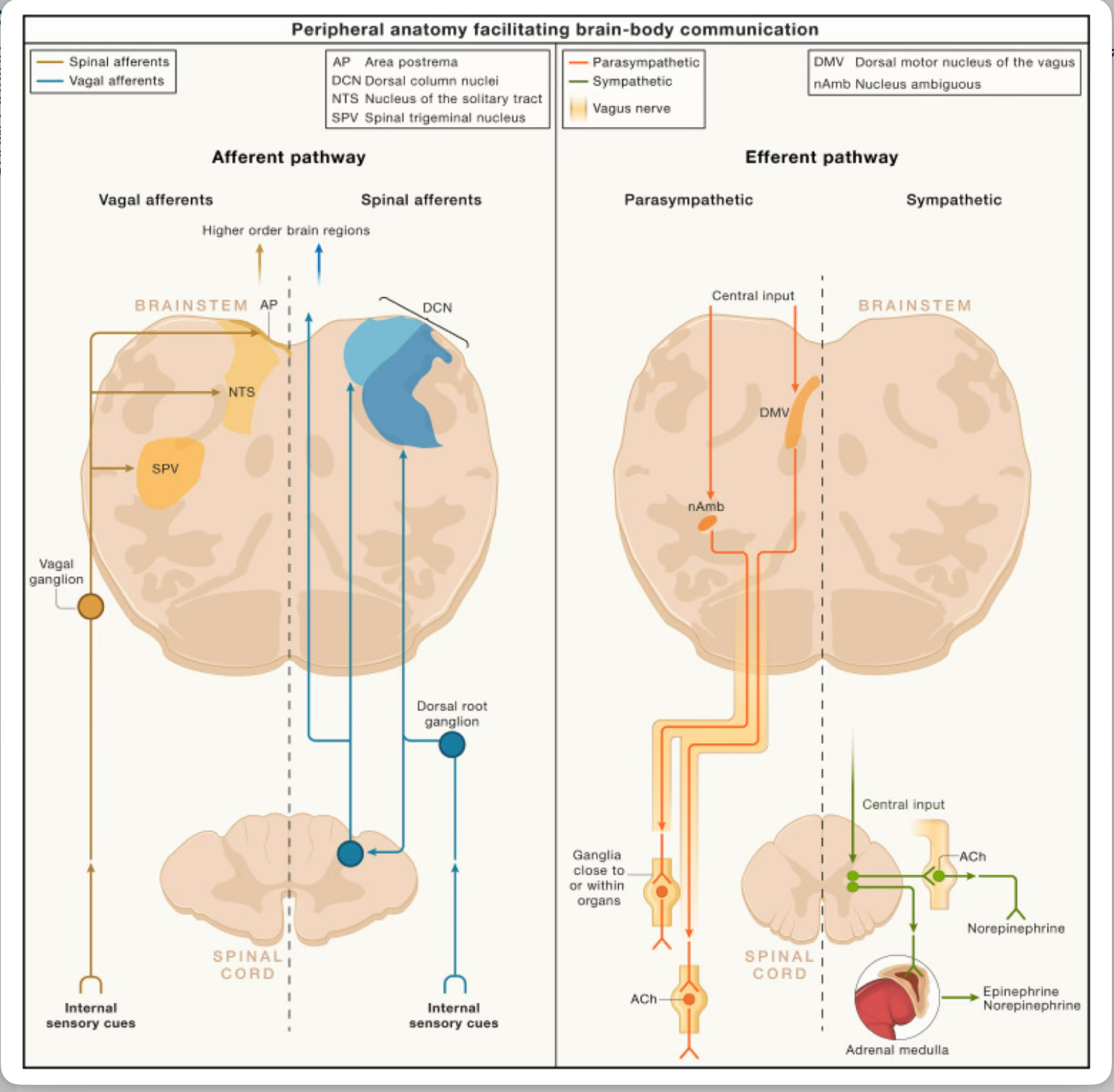
Figura 2 . Anatomía periférica que facilita la comunicación entre el cerebro y el cuerpo
Izquierda: La información sensorial interna llega al cerebro a través de las principales vías humorales y neuronales (vías aferentes).
Derecha: El sistema nervioso autónomo se divide en dos programas principales: los sistemas simpático y parasimpático (vías eferentes).
Todas estas vías están presentes de forma bilateral en el cuerpo y se ilustran de acuerdo con la anatomía humana. El panel izquierdo ilustra las vías aferentes, compuestas por aferentes vagales (izquierda) y espinales (derecha). Los aferentes vagales son neuronas sensoriales pseudounipolares en los ganglios nodosos o yugulares (ganglio vagal en la figura).
Estas neuronas sensoriales envían una rama periférica para inervar los órganos y una rama central al tronco encefálico. Las neuronas nodosas hacen sinapsis en el NTS y, a veces, en el AP, mientras que las neuronas yugulares hacen sinapsis en el SPV.
Esta información sensorial interna se transmite luego desde estos sitios del tronco encefálico a las neuronas de orden superior.
Las aferencias espinales son neuronas pseudounipolares en los ganglios de la raíz dorsal (DRG). Las neuronas DRG extienden una rama periférica para inervar órganos y una rama central al asta dorsal de la médula espinal, y ocasionalmente al DCN en el tronco encefálico.
Esta información sensorial se transmite posteriormente a neuronas de orden superior. El panel derecho ilustra las vías eferentes: sistemas nerviosos simpático y parasimpático. Las señales neuronales descendentes llegan a áreas en el tronco encefálico como el DMV y el nAmb, donde residen las neuronas preganglionares parasimpáticas.
Estas neuronas envían proyecciones a la periferia a través del brazo motor del nervio vago. Las neuronas preganglionares parasimpáticas hacen sinapsis con neuronas posganglionares ubicadas en ganglios cerca o dentro de los órganos diana.
Las neuronas preganglionares liberan ACh para comunicarse con las neuronas posganglionares, que a su vez secretan acetilcolina u otras moléculas para regular la función de los órganos diana. La salida central llega a las neuronas preganglionares simpáticas en la médula espinal.
Estas neuronas preganglionares envían axones cortos para hacer sinapsis con neuronas posganglionares en los ganglios simpáticos paravertebrales o prevertebrales. Una población de neuronas preganglionares simpáticas se proyecta directamente a la médula suprarrenal.
La comunicación entre neuronas preganglionares y posganglionares está mediada por la acetilcolina. Las neuronas posganglionares extienden axones a órganos diana y liberan principalmente noradrenalina para modular las funciones fisiológicas.
Las células cromafines suprarrenales dentro de la médula suprarrenal secretan catecolaminas como la epinefrina y la noradrenalina en la circulación. NTS, núcleo del tracto solitario; AP, área postrema; SPV, núcleo espinal del trigémino; DCN, núcleos de la columna dorsal; DMV, núcleo motor dorsal del vago; nAmb, núcleo ambiguo; ACh, acetilcolina.
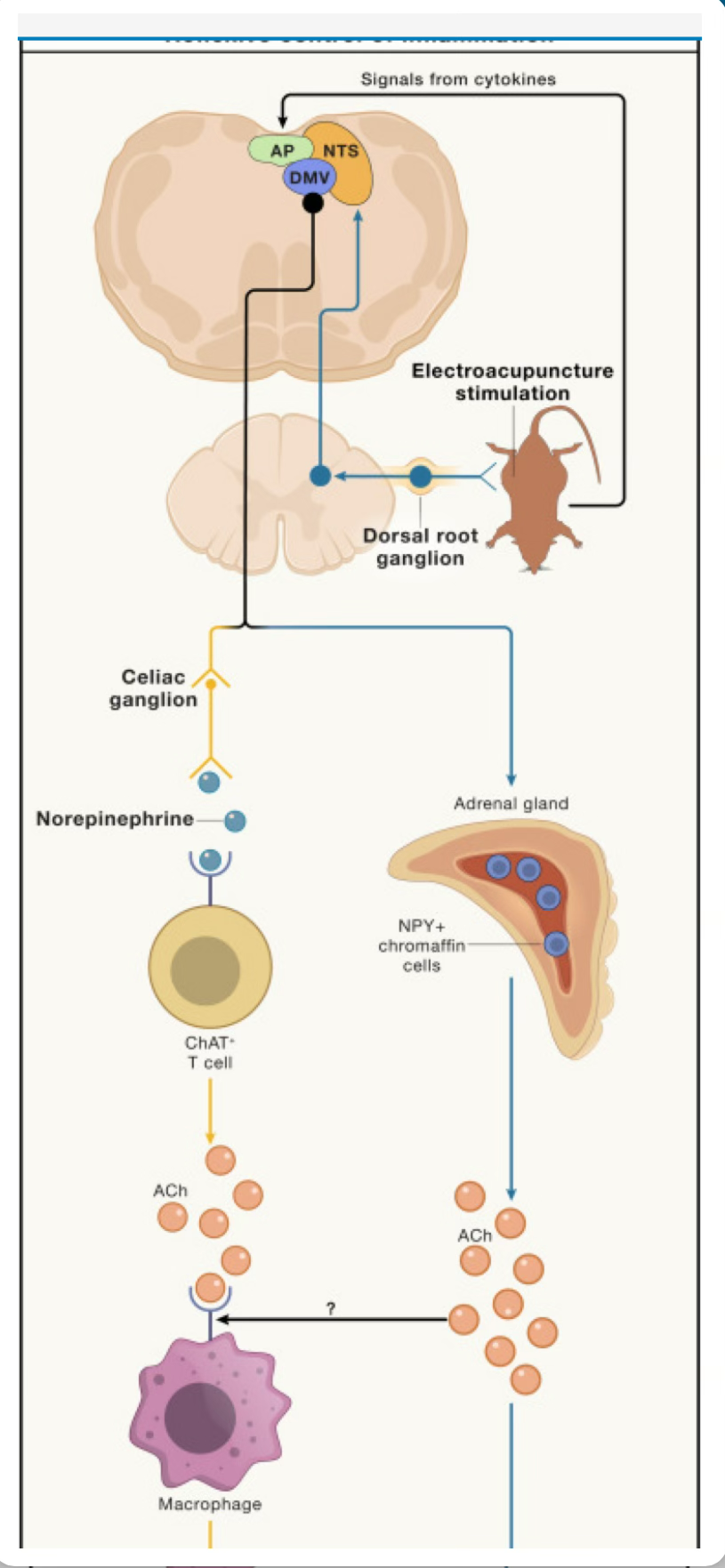
Figura 3 Control reflexivo de la inflamación
Los circuitos reflejos desempeñan un papel fundamental en el mantenimiento de la homeostasis. Durante la inflamación, estos circuitos pueden activarse mediante señales periféricas como las citocinas. Las áreas del tronco encefálico, como el NTS, el AP y el DMV, se activan mediante estas señales para reducir la inflamación o mediar en conductas.
(El reflejo antiinflamatorio, que en última instancia reduce la inflamación, consiste en neuronas posganglionares que se proyectan desde el DMV al bazo y secretan NE, que actúa sobre el B2AR en las células T. Estas células T luego secretan ACh, que ayuda a reducir la inflamación.45
Se pueden activar deliberadamente circuitos similares para reducir la inflamación mediante electroestimulación. Por ejemplo, la estimulación del punto de acupuntura ST36 activa el DMV, que se proyecta a la glándula suprarrenal.46 Aquí, las células cromafines neuropéptido Y (NPY)+ secretan ACh, lo que reduce la inflamación. CG, ganglio celíaco; NE, noradrenalina; B2AR, receptores β2-adrenérgicos.
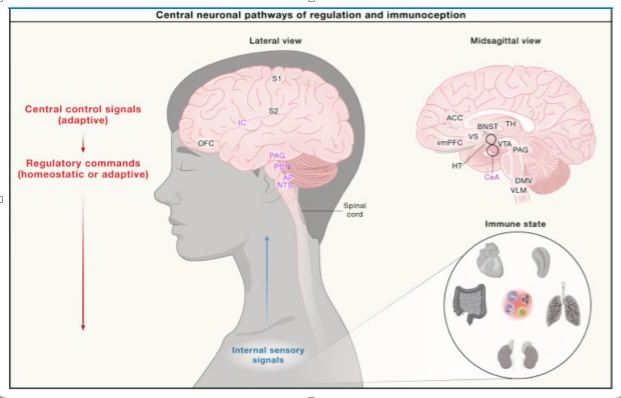
Figura 4.
La información de la periferia, incluidas las señales inmunitarias, se transmite al cerebro a través de aferentes vagales y espinales. Estas vías convergen en el NTS y PBN, ascienden a través del tálamo (p. ej., núcleos ventromedial y ventroposterior lateral) y alcanzan áreas corticales como el IC posterior, ACC, S1 y S2. La información humoral detectada por los CVO (p. ej., IL-6) también se transmite a través de vías neuronales a regiones cerebrales superiores.
Las cortezas visceromotoras, incluidas la aIC, ACC, vmPFC y OFC, median la regulación contextual y adaptativa de la fisiología, iniciando respuestas coordinadas en todos los sistemas fisiológicos y el comportamiento.
Estas respuestas son reclutadas por estructuras subcorticales interconectadas, y el hipotálamo (p. ej., PVN y LHA) desempeña un papel crucial en la detección de necesidades fisiológicas y la mediación del control homeostático al activar respuestas autonómicas, neuroendocrinas, inmunitarias y conductuales motivadas según sea necesario.
La CeA y el BNST participan en el procesamiento de las emociones y el estrés y en el reclutamiento de las respuestas fisiológicas asociadas con su expresión. Otras regiones que contribuyen a los cambios fisiológicos adaptativos incluyen el VS y el VTA, que procesan la recompensa y la motivación, el PAG, que coordina las respuestas conductuales-autonómicas integradas, y los núcleos autónomos como el DMV y el VLM.
La regulación corporal central entre estas y otras regiones cerebrales implica numerosas conexiones moduladoras de retroalimentación y avance en diferentes niveles de la jerarquía neuronal para procesar y controlar el estado fisiológico interno.
Las abreviaturas en violeta corresponden a regiones cerebrales ubicadas más profundamente en el cerebro con respecto a las vistas proporcionadas en la ilustración. NTS, núcleo del tracto solitario; AP, área postrema; PBN, núcleo parabranquial; PAG, sustancia gris periacueductal; TH, tálamo; IC, corteza insular; S1, corteza somatosensorial primaria; S2, corteza somatosensorial secundaria; OFC, corteza orbitofrontal; VLM, bulbo raquídeo ventrolateral; DMV, núcleo motor dorsal del vago; CeA, núcleo central de la amígdala; VTA, área tegmental ventral; HT, hipotálamo; PVN, núcleo paraventricular del hipotálamo; LHA, área hipotalámica lateral; BNST, núcleo del lecho de la estría terminal; VS, estriado ventral; ACC, corteza cingulada anterior; vmPFC, corteza prefrontal ventromedial.