Ronald Palacios Castrillo
Conceptos claves
Hepatocito Célula primaria del hígado. Los hepatocitos constituyen entre el 70 y el 80 % de la masa del hígado y participan en muchas de las funciones clave del hígado, como la desintoxicación y el metabolismo de los carbohidratos y los lípidos.
Además, participan en la producción de proteínas, como la albúmina, los factores de coagulación y diversos factores del complemento, y la bilis. Son infectados por virus hepatotrópicos, como los virus de la hepatitis A, B, C, D y E.
El hígado tiene una notable capacidad de regeneración porque los hepatocitos pueden volver a entrar en el ciclo celular desde una fase inactiva. Sin embargo, en el contexto de una enfermedad hepática crónica, como la infección crónica por el virus de la hepatitis B, son desplazados lentamente por el tejido fibroso, lo que finalmente conduce a cirrosis, insuficiencia hepática y cáncer de hígado.
=> Recibir por Whatsapp las noticias destacadas
Interferón-a Citocina e interferón tipo I sintetizados principalmente por ciertos tipos de células hematopoyéticas después de la estimulación de receptores de reconocimiento de patrones, como los receptores tipo Toll y los receptores tipo RIG-I.
Estos receptores son activados típicamente por el ADN viral y otros patrones moleculares asociados a patógenos. Al unirse al receptor de interferón-a/ß en la superficie de las células dendríticas, los interferones de tipo I activan procesos posteriores que resultan en la inducción de genes estimulados por interferón, que tienen innumerables efectos antivirales.
Además, los interferones de tipo I estimulan las respuestas inmunitarias celulares innatas y adaptativas al activar las células B, las células T y las células asesinas naturales. La adición de un grupo de polietilenglicol al interferón alfa (lo que resulta en interferón alfa pegilado) prolonga su vida media y permite una administración de dosis menos frecuente que con el interferón alfa.
Receptor tipo Toll Proteína receptora expresada por macrófagos y otras células que detectan y responden a los patógenos. (Los receptores tipo Toll también se conocen como receptores de reconocimiento de patrones).
Ciertos receptores tipo Toll (p. ej., TLR7 y TLR8) pueden reconocer moléculas ampliamente compartidas por patógenos (los llamados patrones moleculares asociados a patógenos o PAMP) que son distintas de las moléculas normales del huésped. Ciertos receptores tipo Toll (p. ej., TLR7) desempeñan un papel en la activación de células B autorreactivas y células dendríticas por autoantígenos.
La activación de los receptores tipo Toll (que se expresan en células inmunes innatas y otros tipos de células) por PAMP inicia una respuesta inmune que implica la producción de interferones tipo I y otras citocinas. Los agonistas de los receptores tipo Toll están bajo investigación para el tratamiento de infecciones virales y cáncer.
Hou et al.[1] describen la eficacia y seguridad de 48 semanas de tratamiento con xalnesiran, un agente terapéutico de interferencia de ARN, solo o en combinación con un inmunomodulador en pacientes con infección crónica por el virus de la hepatitis B (VHB) ya tratados con un análogo de nucleósido o nucleótido.
Los inmunomoduladores utilizados en el ensayo fueron interferón alfa-2a pegilado y ruzotolimod. El criterio de valoración principal, la pérdida del antígeno de superficie de la hepatitis B (HBsAg) a las 24 semanas de finalizado el período de tratamiento, no se observó en ninguno de los pacientes tratados solo con análogos de nucleósidos o nucleótidos, sino en el 3 a 7% de los tratados solo con xalnesiran, el 12% de los tratados con xalnesiran y ruzotolimod y el 23% de los tratados con xalnesiran e interferón alfa-2a pegilado.
Se observó una erosión del efecto supresor sobre el HBsAg tras la retirada de xalnesiran solo o combinado con un modulador inmunitario.
Sin embargo, estos resultados anuncian una nueva era para la terapia combinada para tratar la infección crónica por VHB y plantean preguntas sobre cómo y cuándo evaluar la respuesta y cómo equilibrar la probabilidad de respuesta con la probabilidad de un beneficio clínico duradero y el riesgo de efectos secundarios.
¿Cuál es la carga mundial de la infección crónica por VHB?
La infección crónica por VHB afecta a más del 3% de la población mundial[2] y es responsable de aproximadamente 1,1 millones de muertes al año.
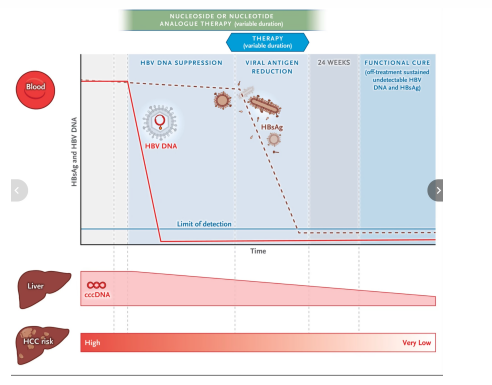
La muerte prematura de los pacientes se debe predominantemente a complicaciones de cirrosis, hipertensión portal y carcinoma hepatocelular (Figura 1)[3].
Por lo tanto, la detección de casos y el tratamiento de los pacientes con riesgo de complicaciones relacionadas con el hígado son esenciales para mitigar esta importante amenaza para la salud mundial[FIGURA 1]
Nuevos paradigmas de tratamiento en la infección crónica por el virus de la hepatitis B (VHB): de la supresión viral a la cura funcional.
¿Qué es la cura funcional de la infección crónica por VHB?
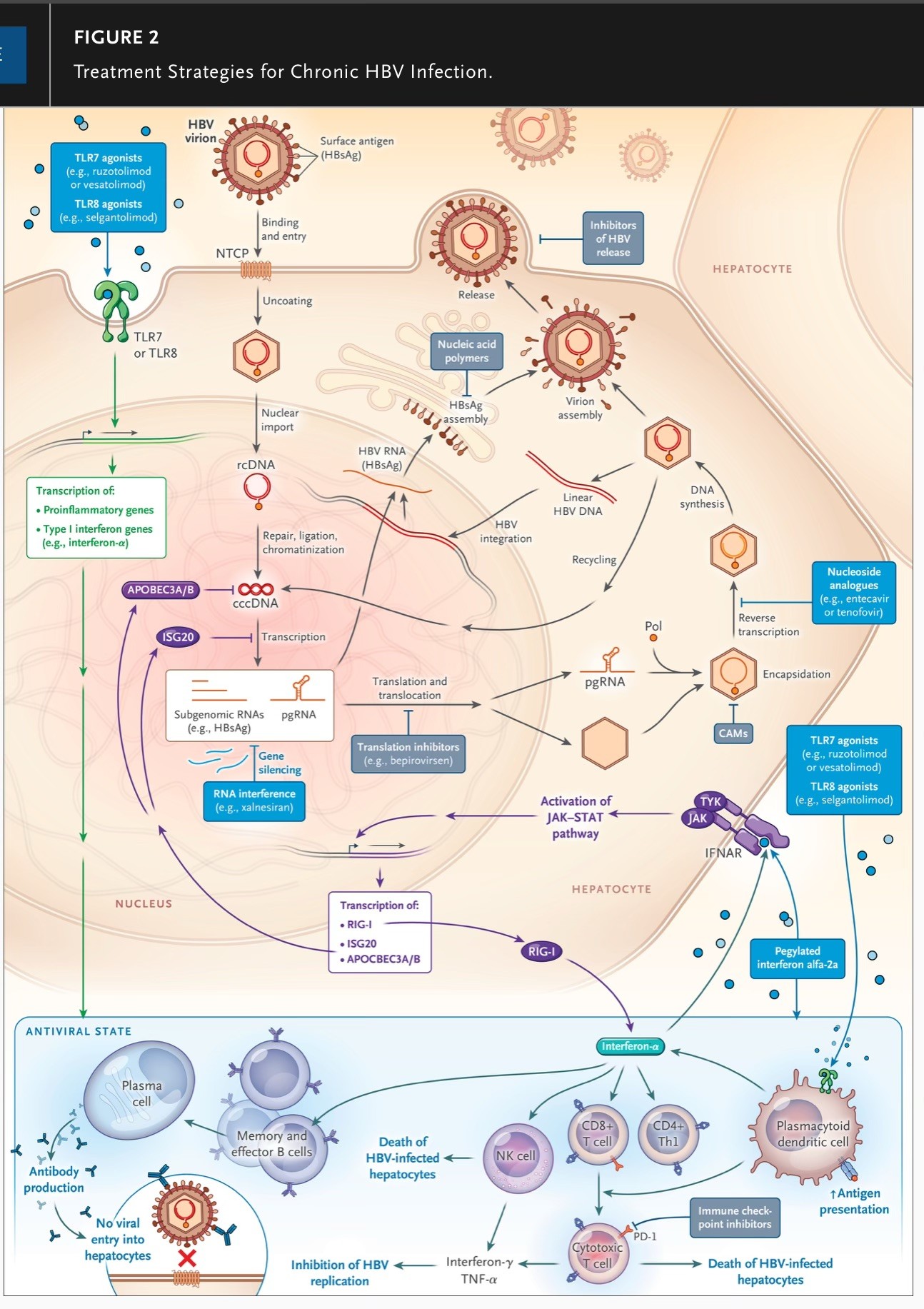
El VHB utiliza el polipéptido cotransportador de taurocolato de sodio (NTCP) de la superficie celular para ingresar a los hepatocitos (ver Conceptos clave), después de lo cual su genoma se convierte en un ADN circular cerrado covalentemente (ADNccc); luego se establece un reservorio de ADNccc del VHB en el núcleo celular.
El ADNccc proporciona la plantilla a partir de la cual se sintetizan los ARN del VHB; estos son vitales tanto para la replicación viral como para la producción de proteínas virales, incluido el HBsAg (Figura 2).
Es importante destacar que el ADN viral también puede integrarse en el ADN del huésped, convirtiéndose así en una fuente independiente de producción de HBsAg[4].
Debido a que la erradicación del reservorio de ADNccc no se puede lograr con los tratamientos actuales (excepto el trasplante de hígado), un punto final comúnmente utilizado es una «cura funcional», definida como ADN del VHB y HBsAg indetectables sostenidos sin tratamiento.
La cura funcional prácticamente elimina el riesgo de progresión de la fibrosis hepática, en ausencia de otra enfermedad hepática coexistente, y reduce profundamente el riesgo de carcinoma hepatocelular entre pacientes sin cirrosis establecida.
Otras ventajas de una cura funcional incluyen evitar los efectos secundarios a largo plazo y los costos de la medicación y el estigma continuo.
Estrategias de tratamiento para la infección crónica por VHB.
Si no se puede lograr una cura funcional, la supresión de los niveles de ADN del VHB con HBsAg persistentemente positivo puede ser un segundo mejor resultado. Sin embargo, este resultado está asociado con un exceso de riesgo de carcinoma hepatocelular en comparación con la cura funcional.
¿Cuál es el estándar de atención?
Los análogos de nucleósidos o nucleótidos forman actualmente la columna vertebral de la terapia para la mayoría de los pacientes con infección crónica por VHB que tienen acceso al tratamiento. Interrumpen la síntesis de ADN del VHB al unirse competitivamente a la polimerasa del VHB (la enzima viral que genera copias de ADN del VHB) y, por lo tanto, suprimen los niveles de ADN del VHB en el suero; logran la supresión completa del ADN del VHB en la sangre periférica en casi todos los pacientes que cumplen el tratamiento.
Sin embargo, el tratamiento debe continuarse a largo plazo. Los análogos de nucleósidos y nucleótidos no afectan otros pasos en el ciclo de replicación viral y, por lo tanto, no eliminan los antígenos virales, incluido el HBsAg, por lo que casi nunca brindan una cura funcional[4].
Aunque el tratamiento con análogos de nucleósidos o nucleótidos se asocia con una disminución en la gravedad de la fibrosis hepática y una reducción de las complicaciones relacionadas con el hígado, el riesgo de carcinoma hepatocelular persiste a nivel de la población porque no se logra la cura funcional en la mayoría de los pacientes[5].
¿Cómo contrarresta el xalnesiran al VHB?
Xalnesiran es un ARN interferente pequeño (siRNA) que se dirige a la región S conservada (que codifica el antígeno de superficie) del genoma del VHB.
Después de su administración al hepatocito, que se facilita mediante la conjugación de una N-acetil-d-galactosamina (GalNAc) a un extremo del ARN bicatenario, este último se carga en un complejo proteico llamado complejo de silenciamiento inducido por ARN (RISC). Después de que se descarta la denominada cadena pasajera, la cadena guía expuesta se empareja con el ARN mensajero objetivo, que luego se corta y se degrada por un componente enzimático del RISC.
El resultado es la supresión prolongada de una miríada de transcripciones de ARN sintetizadas a partir del ADNccc y del ADN del VHB integrado (Figura 1).
En un ensayo de fase 1, el tratamiento con cuatro dosis mensuales de xalnesiran condujo a reducciones marcadas en los niveles séricos de HBsAg que se mantuvieron hasta un año de seguimiento posterior.
Dada la rápida disminución de los niveles de HBsAg observada con el tratamiento a corto plazo con siRNA, se esperaban altas tasas de eliminación de HBsAg con el tratamiento prolongado, pero los estudios de monoterapia con siRNA a largo plazo mostraron una estabilización de la disminución de los niveles de HBsAg después de varios meses[6]. Por lo tanto, rara vez se observa una curación funcional con la monoterapia con siRNA.
¿Y el interferón alfa y el ruzotolimod?
La persistencia de la hepatitis B crónica es atribuible a respuestas inmunitarias innatas y adaptativas disfuncionales al VHB. Por lo tanto, la revitalización de la respuesta inmunitaria podría ser clave para aumentar la probabilidad de curación funcional.
El interferón alfa tiene efectos tanto en la inmunidad innata como en la adaptativa y tiene efectos antivirales mediados por la inducción de genes estimulados por interferón (Figura 1), cuyos efectos posteriores pueden resultar en la erradicación del cccDNA de los hepatocitos, así como en la supresión de la replicación del VHB en diferentes etapas del ciclo de vida viral[7].
El interferón alfa pegilado está autorizado para el tratamiento de la infección crónica por VHB durante hasta 48 semanas y da como resultado una incidencia significativamente mayor de curación funcional que la terapia con análogos de nucleósidos o nucleótidos[8].
Sin embargo, la aplicación clínica del interferón alfa pegilado está limitada por los efectos secundarios, como síntomas similares a los de la gripe, fatiga, pérdida de peso, cambios de humor y citopenia, y por lo tanto, se usa con poca frecuencia como monoterapia.
El ruzotolimod es un agonista del receptor tipo Toll 7 (TLR7) administrado por vía oral que se encuentra bajo investigación.
Los receptores tipo Toll son miembros de la familia de receptores de reconocimiento de patrones que tienen un papel importante en el sistema inmunitario innato a través del reconocimiento de patógenos.
Se ha demostrado que la estimulación de TLR7 induce la liberación de citocinas, incluidos los interferones de tipo I, que activan las células asesinas naturales, las células T y las células dendríticas intrahepáticas. En un estudio de fase 1,9 el tratamiento con ruzotolimod se asoció con síntomas sistémicos leves asociados con la inducción del sistema inmunitario, incluida una enfermedad similar a la gripe, que recuerda a la terapia con interferones.
El tratamiento a corto plazo con agonistas de TLR7 se asoció con un aumento de la producción de citocinas, pero una disminución limitada de los niveles de ADN del VHB y HBsAg[9,10].
¿Por qué combinar un antiviral con un inmunomodulador?
La combinación de fármacos que actúan sobre diferentes dianas puede generar un efecto sinérgico en la supresión viral y el control inmunológico, lo que conduce a una cura funcional.
Este concepto está respaldado por varios ensayos de tratamiento combinado para la infección crónica por VHB que mostraron que la combinación de análogos de nucleósidos o nucleótidos con interferón alfa pegilado resultó en mayores disminuciones en los niveles de ADN y antígeno viral del VHB durante el tratamiento y una incidencia potencialmente mayor de curación funcional que con cualquiera de los tratamientos solos.11.
Además, la adición de interferón alfa pegilado a la terapia a largo plazo con análogos de nucleósidos o nucleótidos en ensayos aleatorios resultó en una mayor incidencia de curación funcional y una mayor disminución en los niveles de HBsAg, aunque en un grado modesto[12,13].
Debido a que el agotamiento inmunológico que está relacionado con una alta carga de antígenos virales parece tener un papel importante en la cronicidad de la infección por VHB, la reducción de la carga de antígenos virales con interferencia de ARN podría ayudar a restaurar la respuesta inmune, facilitando potencialmente la eliminación viral después de la terapia inmunomoduladora.14.
¿Qué sigue?
Se necesitan más datos sobre la durabilidad del efecto logrado con nuevos agentes que interfieren directamente con la producción de HBsAg.
Los resultados informados por Hou et al. indican un riesgo de recaída, lo que socava la elección de la curación funcional como punto final para estos agentes, al menos cuando se evalúa relativamente temprano después de la retirada de la terapia.
Los ensayos futuros podrían evaluar si los regímenes de tratamiento alternativos, como los medicamentos con diferente compromiso objetivo, podrían aumentar la probabilidad de respuesta. Hou et al. observaron que la curación funcional se logró solo en pacientes con un nivel basal de HBsAg de menos de 1000 UI por mililitro.
Aunque una proporción sustancial de pacientes tienen niveles de HBsAg igualmente bajos, los pacientes con niveles más altos de HBsAg tienen el mayor riesgo de resultados adversos relacionados con el hígado y, por lo tanto, son los que más tienen que ganar con las nuevas terapias; por lo tanto, desarrollar estrategias de tratamiento que logren una curación funcional en dichos pacientes es un objetivo importante.
Un desafío adicional será identificar las poblaciones de pacientes con más probabilidades de tener una respuesta a tratamientos específicos.
Figura 1. Nuevos paradigmas de tratamiento en la infección crónica por el virus de la hepatitis B (VHB): de la supresión viral a la curación funcional.
Los pacientes con niveles elevados de ADN del VHB en sangre periférica y signos de inflamación hepática tienen una indicación de terapia antiviral.
En esta etapa de la enfermedad, los niveles intrahepáticos de ADN circular cerrado covalentemente (ADNccc) también son elevados, al igual que el riesgo de carcinoma hepatocelular (CHC).
Los análogos de nucleósidos y nucleótidos suprimen eficazmente los niveles de ADN del VHB, pero tienen poco efecto en la producción de antígeno viral. La combinación concomitante con otros fármacos con diferentes modos de acción, o la adición de estos, como la interferencia directa con la producción de antígeno viral y la modulación inmunitaria, puede ayudar a disminuir los niveles de antígeno de superficie de la hepatitis B (HBsAg) y dar como resultado la curación funcional.
La supresión del ADN del VHB por sí sola puede reducir el riesgo de CHC en comparación con la ausencia de tratamiento, pero el logro de la curación funcional se asocia con el menor riesgo residual de CHC entre los pacientes sin otra enfermedad hepática coexistente o cirrosis establecida.
Figura 2. Estrategias de tratamiento para la infección crónica por VHB.
Se describen los pasos principales del ciclo de vida del VHB y los enfoques antivirales e inmunomoduladores.
Más específicamente, los análogos de nucleósidos o nucleótidos inhiben principalmente la actividad de la polimerasa (Pol) para suprimir la producción de ADN del VHB. Xalnesiran es un ARN interferente pequeño conjugado con N-acetil-d-galactosamina que se dirige a la región conservada S del genoma del VHB y silencia las transcripciones virales sintetizadas a partir del ADNccc y el ADN del VHB integrado (no se muestra la inhibición de las transcripciones sintetizadas a partir del ADN del VHB integrado).
Ruzotolimod es un agonista del receptor tipo Toll 7 (TLR7) que induce un estado antiviral principalmente mediante la producción de interferones de tipo I por las células inmunes, especialmente las células dendríticas plasmocitoides. La secreción de interferón-α a través de la inducción por ruzotolimod o por medio de la administración de interferón alfa-2a pegilado ejerce actividad antiviral a través
de la unión a los receptores de la superficie celular en los hepatocitos para activar la vía de la cinasa Janus (JAK)-transductor de señales y activador de la transcripción (JAK-STAT), induciendo la expresión de genes estimulados por interferón (ISG), los efectores antivirales finales que inhiben varios pasos del ciclo de replicación viral.
Entre estos ISG, APOBEC3A/B e ISG20 median la degradación del cccDNA. RIG-I es un receptor de reconocimiento de patrones intracelular que después de la estimulación también activa vías que resultan en la inducción de citocinas proinflamatorias, incluido el interferón.
El interferón-α tiene muchos efectos sobre la infección crónica por VHB. Activa las células dendríticas, promoviendo su presentación de antígenos, además de los linfocitos T CD4 y CD8. Aumenta el número de células B de memoria y efectoras.
Su activación de las células asesinas naturales (NK) y las células T citotóxicas da como resultado la destrucción de los hepatocitos infectados por el VHB y la producción de citocinas (p. ej., interferón-γ y factor de necrosis tumoral α [TNF-α]) que suprimen la replicación del VHB en los hepatocitos.
CAMs denota moduladores del ensamblaje de la cápside, receptor de interferón-α IFNAR, polipéptido cotransportador de taurocolato de sodio NTCP, muerte programada 1 PD-1, ARN pregenómico pgRNA, ADN circular relajado rcDNA, célula T colaboradora tipo 1 Th1, receptor tipo toll 8 TLR8 y tirosina quinasa TYK.
Referencias Bibliográficas
1. Hou J, Zhang W, Xie Q, et al. Xalnesiran with or without an immunomodulator in chronic hepatitis B. N Engl J Med 2024;391:2097-2109.
Go to Citation
2. Polaris Observatory Collaborators. Global prevalence, cascade of care, and prophylaxis coverage of hepatitis B in 2022: a modelling study. Lancet Gastroenterol Hepatol 2023;8:879-907.
Go to Citation
3. World Health Organization. Global hepatitis report 2024: action for access in low- and middle-income countries. April 9,2024 (https://www.who.int/publications/i/item/9789240091672).
Go to Citation
4. Dusheiko G, Agarwal K, Maini MK. New approaches to chronic hepatitis B. N Engl J Med 2023;388:55-69.
5. Yip TC-F, Wong GL-H, Chan HL-Y, et al. HBsAg seroclearance further reduces hepatocellular carcinoma risk after complete viral suppression with nucleos(t)ide analogues. J Hepatol 2019;70:361-370.
Go to Citation
6. Gane EJ, Kim W, Lim TH, et al. First-in-human randomized study of RNAi therapeutic RG6346 for chronic hepatitis B virus infection. J Hepatol 2023;79:1139-1149.
Go to Citation
7. Gehring AJ, Protzer U. Targeting innate and adaptive immune responses to cure chronic HBV infection. Gastroenterology 2019;156:325-337.
Go to Citation
8. Lau GK, Piratvisuth T, Luo KX, et al. Peginterferon alfa-2a, lamivudine, and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med 2005;352:2682-2695.
Go to Citation
9. Yuen M-F, Balabanska R, Cottreel E, et al. TLR7 agonist RO7020531 versus placebo in healthy volunteers and patients with chronic hepatitis B virus infection: a randomised, observer-blind, placebo-controlled, phase 1 trial. Lancet Infect Dis 2023;23:496-507.
10. Janssen HLA, Brunetto MR, Kim YJ, et al. Safety, efficacy and pharmacodynamics of vesatolimod (GS-9620) in virally suppressed patients with chronic hepatitis B. J Hepatol 2018;68:431-440.
Go to Citation
11. Marcellin P, Ahn SH, Ma X, et al. Combination of tenofovir disoproxil fumarate and peginterferon α-2a increases loss of hepatitis B surface antigen in patients with chronic hepatitis B. Gastroenterology2016;150(1):134-144.e10.
Go to Citation
12. Farag MS, van Campenhout MJH, Sonneveld MJ, et al. Addition of PEG-interferon to long-term nucleos(t)ide analogue therapy enhances HBsAg decline and clearance in HBeAg-negative chronic hepatitis B: multicentre randomized trial (PAS Study). J Viral Hepat 2024;31:197-207.
Go to Citation
13. Bourlière M, Rabiega P, Ganne-Carrie N, et al. Effect on HBs antigen clearance of addition of pegylated interferon alfa-2a to nucleos(t)ide analogue therapy versus nucleos(t)ide analogue therapy alone in patients with HBe antigen-negative chronic hepatitis B and sustained undetectable plasma hepatitis B virus DNA: a randomised, controlled, open-label trial. Lancet Gastroenterol Hepatol 2017;2:177-188.
Go to Citation
14. Yang S, Zeng W, Zhang J, Lu F, Chang J, Guo J-T. Restoration of a functional antiviral immune response to chronic HBV infection by reducing viral antigen load: if not sufficient, is it necessary? Emerg Microbes Infect 2021;10:1545-1554.