Ronald Palacios Castrillo, M.D.,PhD.
El término amplio “inflamación” abarca un conjunto diverso de reacciones tisulares desencadenadas clásicamente por el reconocimiento microbiano y por daño tisular(1,2). Más recientemente, se ha reconocido que las condiciones dismetabólicas, que van desde la diabetes hasta la obesidad, provocan reacciones inflamatorias manifiestas o subclínicas.
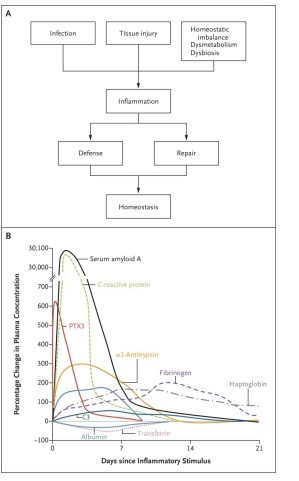
El papel general de las reacciones inflamatorias es la amplificación de la inmunidad innata y la reparación tisular, lo que conduce a un retorno a la homeostasis (Figura 1A).
Las manifestaciones sistémicas de la inflamación incluyen fiebre, alteraciones en el recuento de leucocitos, reacciones cardiovasculares, respuestas endócrinas y reorientación del metabolismo en asociación con una mayor producción de un conjunto diverso de moléculas denominadas proteínas de fase aguda(4,5).
=> Recibir por Whatsapp las noticias destacadas
La proteína prototípica de fase aguda, proteína C reactiva, se describió originalmente como una molécula que estaba presente en la circulación de pacientes con infecciones y que era capaz de reconocer los polisacáridos tipo C de Streptococcus pneumoniae(6,7).
La aparición de niveles elevados de proteínas de fase aguda en la sangre y otros fluidos corporales (Figura 1B) es parte de una respuesta más compleja a la inflamación local o a la inflamación sistemica (p. ej., sepsis) que se ha denominado respuesta de fase aguda(5) ,que se caracteriza por una producción reducida de albúmina por los hepatocitos, reorientación del metabolismo del hierro y cambios hormonales(4,5). Estas alteraciones también se observan en el contexto de enfermedades inflamatorias crónicas e inflamación subclínica.
Casi un siglo después del descubrimiento de la proteína C reactiva, las proteínas de fase aguda continúan sirviendo como herramientas diagnósticas fundamentales que tienen aplicaciones en pacientes con una variedad de afecciones, incluidas infecciones, enfermedades cardiovasculares, cáncer, neurodegeneración y dismetabolismo(8-10).
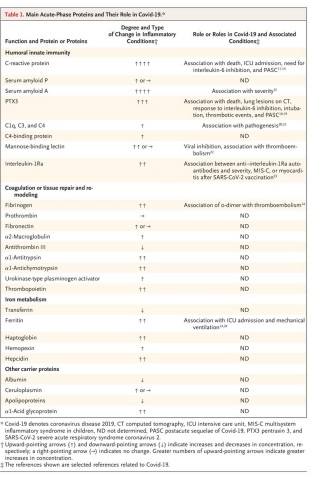
Durante la pandemia de la enfermedad por coronavirus 2019 (Covid-19), las proteínas de fase aguda como la proteína C reactiva, el fibrinógeno y su producto de degradación dímero D y la ferritina han servido como herramientas invaluables en el manejo diario de enfermedades y como indicadores pronósticos (tabla 1).
Se ha avanzado en la disección de la producción, estructura y función de muchas de estas moléculas, y los hallazgos han indicado que una función fundamental de la respuesta de fase aguda es amplificar la resistencia a los antimicrobianos y la reparación de tejidos, con muchas de las respuestas de fase aguda, proteínas que sirven como componentes clave de la inmunidad innata humoral (“ante-anticuerpos”)(25).
Desde esta perspectiva general, revisamos aspectos clave de la producción, estructura y función de proteínas de fase aguda seleccionadas, que continúan representando herramientas diagnósticas fundamentales que podría integrarse más sistemáticamente en las firmas moleculares que han surgido recientemente de los perfiles transcriptómicos y proteómicos.
El contexto: inmunidad innata celular y humoral
La inmunidad innata es una primera línea de resistencia frente a patógenos microbianos y está implicada en la activación de respuestas inmunitarias adaptativas, así como en la reparación de tejidos.
La inmunidad innata se compone de un brazo celular y un brazo humoral. Las estratégias moleculares utilizadas por el brazo celular para detectar fracciones microbianas y daño tisular involucran moléculas de reconocimiento de patrones asociadas a células ubicadas en diferentes compartimentos celulares (membrana plasmática, endosomas y citoplasma) y que pertenecen a diferentes familias moleculares, incluidos los receptores tipo toll (TLR), dominio de oligomerización de unión a nucleótidos (NOD) y receptores similares al gene I inducible por ácido retinoico (RIG-I), inflamasomas, estimulador de genes de interferón (STING), lectinas de tipo C y receptores depuradores (Figura 2 ).
La activación de estos receptores da lugar a la expresión de citocinas (incluidos interferones y quimiocinas), moléculas de adhesión y efectores antimicrobianos o a la eliminación de microbios a través de la fagocitosis(1,2,25).
El brazo humoral del sistema inmunitario innato está formado por diferentes clases de moléculas, como pentraxinas, colectinas y ficolinas, que actúan funcionalmente como ancestros de los anticuerpos (anteanticuerpos) iniciando la activación del complemento, opsonizando microbios y células dañadas, aglutinando o neutralizar microbios y regular la inflamación(25).
Como se analiza a continuación, algunas de estas moléculas son componentes clave de la respuesta de fase aguda (Tabla 1) que son rápidamente inducidas en las células hepáticas u otros tipos de células por citoquinas inflamatorias primarias o fracciones microbianas.
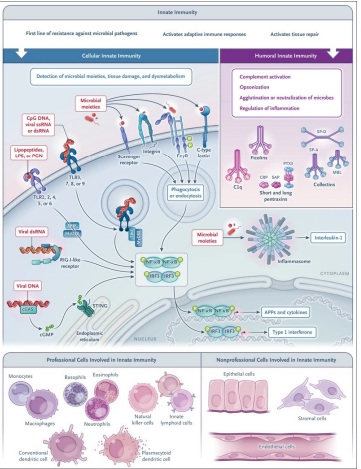
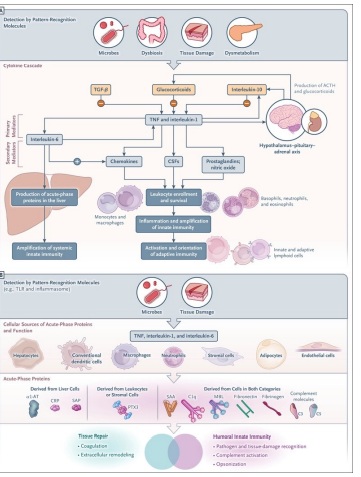
Tabla 1.
La cascada de citocinas y las fuentes y funciones celulares de las proteínas de fase aguda.
La detección de fracciones microbianas, daño tisular o dismetabolismo por parte de moléculas de reconocimiento de patrones celulares pone en marcha una cascada de citoquinas que induce la amplificación y regulación de la inmunidad innata y la producción de proteínas de fase aguda, como se muestra en la Figura 3A.
Las citocinas inflamatorias primarias, típicamente interleucina-1, interleucina-6 y factor de necrosis tumoral (TNF), inducen la producción de mediadores secundarios en los tejidos (p. ej., la propia interleucina-6, quimiocinas, factores estimulantes de colonias, moléculas de adhesión endotelial, prostaglandinas y óxido nítrico); estos mediadores amplifican el reclutamiento de leucocitos, las funciones efectoras y la inmunidad innata local.
La amplificación de la inmunidad innata local prepara el escenario para la activación y orientación de las respuestas inmunitarias adaptativas (específicas de antígeno).
Además de estimular la producción de quimiocinas y favorecer la transición de la inflamación aguda a la crónica, la interleucina-6 es un potente inductor de la producción de proteínas de fase aguda en el hígado a través de la reprogramación y reorientación de las funciones metabólicas (p. ej., disminución de la producción de albúmina y aumento de la producción de proteínas de fase aguda).
Las citocinas inflamatorias también actúan sobre el sistema nervioso central a través de la activación del eje hipotálamo-hipófisis-suprarrenal, lo que resulta en la producción de hormona adrenocorticotrópica y hormonas glucocorticoides.
Las hormonas glucocorticoides, entre sus muchas funciones, actúan como reguladores negativos de la inflamación al suprimir, por ejemplo, la interleucina-1 e inducir el receptor señuelo de la interleucina-1, la interleucina-1R (2,26).Las citocinas antiinflamatorias (interleucina-10, factor de crecimiento transformante β e interleucina-1 Ra) también forman parte de vías de regulación negativa (Figura 3A).
Entre estas citocinas antiinflamatorias, la interleucina-1Ra, que actúa como antagonista de la interleucina-1R, se ha considerado clásicamente una proteína de fase aguda derivada del hígado (27) y es un producto de los macrófagos y otros tipos de células en los tejidos.
La interleucina-1 y la interleucina-6 son los reguladores clave de la síntesis de proteínas de fase aguda en el hígado a través de la activación de una red de factores de transcripción (transductor de señal y activador de la transcripción 3 [STAT3], factor nuclear κB y CCAAT/potenciador), proteínas de unión) y la metilación de motivos CpG en los sitios de unión de estos factores de transcripción(28).
Fuentes hepáticas y no hepáticas de proteínas de fase aguda
El hígado se ha considerado clásicamente la fuente de los niveles sanguíneos elevados de proteínas de fase aguda (4) (Figura 3A). Se producen aproximadamente 200 proteínas de fase aguda, principalmente por los hepatocitos, pero otros tipos de células también contribuyen a la reacción de fase aguda.
Estos tipos de células incluyen monocitos infiltrantes de órganos y macrófagos residentes en tejidos como las células de Kupffer, las células estrelladas hepáticas y las células endoteliales, todas las cuales son fuentes de citocinas proinflamatorias que activan la síntesis de proteínas de fase aguda por parte de los hepatocitos(28).
La evidencia sugiere que, además de los hepatocitos, las células de los tejidos periféricos pueden producir algunas proteínas de fase aguda (Figura 3B). Por ejemplo, los macrófagos y las células endoteliales pueden producir componentes del complemento( 29), amiloide sérico A (SAA)( 30), transportadores de hierro, α1-antitripsina(31), e interleucina-1Ra.
La pentraxina, pariente de la proteína C reactiva, la pentraxina 3 (PTX3), se libera principalmente en los tejidos periféricos por diversos tipos de células, sobre todo los fagocitos y las células endoteliales, al ser inducidas por fracciones microbianas o citocinas inflamatorias.
A nivel tisular , la producción local complementa la función de las proteínas circulantes de fase aguda producidas por los hepatocitos (Figura 3B).
Por ejemplo, el tejido adiposo es una fuente importante de la concentración sistémica general de proteínas de fase aguda en respuesta a estímulos proinflamatorios (interleucina-1 e interleucina-6). Los adipocitos expresan grandes cantidades de factores del complemento (C3, D y B), glucoproteína ácida α1 y lipocalina-2, así como inhibidor del activador del plasminógeno 1 (PAI-1) y amiloide sérico A3 (SAA3) (32).
En la miopatía, el desgaste del músculo esquelético y la atrófia asociada con enfermedades críticas, la interleucina-6 y el TNF producidos localmente contribuyen a la inducción de proteínas de fase aguda en las células musculares. En esta condición, las citocinas inflamatorias primarias y el amiloide sérico A1 (SAA1) contribuyen a la atrofia muscular(33).
Moléculas y funciones
PENTRAXINAS
Las pentraxinas son una familia de proteínas conservadas evolutivamente caracterizadas por una estructura multimérica cíclica y por la presencia de un dominio de pentraxina conservado de 200 aminoácidos.
La proteína C reactiva (también llamada PTX1) y el componente P amiloide sérico (SAP o PTX2) son pentraxinas cortas pentaméricas (35).
La proteína C reactiva es una proteína prototípica de fase aguda derivada del hígado en humanos, mientras que SAP es la principal proteína de fase aguda en ratones. En los seres humanos, los niveles plasmáticos de proteína C reactiva aumentan hasta 1000 veces en respuesta a un estímulo de fase aguda, en particular a la interleucina-6, mientras que SAP está presente de forma constitutiva en el plasma.
Por el contrario, PTX3 se induce rápidamente en respuesta a la interleucina-1 y el TNF o componentes microbianos en varios tipos de células, en particular, células mielomonocíticas (monocitos, macrófagos, células dendríticas), células endoteliales vasculares y linfáticas y células del estroma (35).
Los neutrófilos sintetizan PTX3 durante la mielopoiesis, almacenarlo en gránulos positivos para lactoferrina y liberarlo rápidamente después del reconocimiento microbiano (36). Por lo tanto, PTX3 difiere de las pentraxinas cortas en términos de estructura, origen celular y regulación.
La proteína C reactiva, SAP y PTX3 se unen a varias bacterias, hongos y virus, lo que promueve respuestas inmunitarias innatas a estos patógenos (25,34,37,38) por estas células en un modo no inflamatorio( 39).
La proteína C reactiva, SAP y PTX3 interactúan con diferentes moléculas del complemento (por ejemplo, C1q, ficolinas y lectina de unión a manosa [MBL]), lo que conduce a un potencial de reconocimiento mejorado y más amplio.
Además de promover la opsonización dependiente del complemento, las pentraxinas cortas y PTX3 promueven la fagocitosis de microbios y células apoptóticas al interactuar con FcγR, particularmente con FcγRIII (también llamado CD16) y FcγRII (CD32) (40) (Figura 2). También interactúan con los reguladores del complemento, como el factor H y C4BP, lo que promueve la regulación de la inflamación dependiente del complemento.
Los polimorfismos genéticos están asociados con niveles elevados de proteína C reactiva, y los niveles de proteína C reactiva en sangre están asociados con el riesgo de enfermedad coronaria (8,9). Esta asociación sugirió un papel patogénico de la proteína C reactiva en la aterosclerosis.
El análisis de aleatorización mendeliana en una gran cohorte de pacientes con enfermedad coronaria mostró que las concentraciones genéticamente aumentadas de proteína C reactiva no están relacionadas con los factores de riesgo convencionales y el riesgo de eventos cardiovasculares (41).
SAP se une y estabiliza todas las formas de fibrillas de amiloide, lo que contribuye a la amiloidosis (34,42). SAP también se une a componentes de la matriz extracelular, como laminina, colágeno tipo IV, fibronectina y proteoglicanos, regulando así el depósito de matriz extracelular e inhibiendo la fibrosis.
En la fibrosis pulmonar idiopática, el SAP humano (PRM-151) mejora la función pulmonar (43), al inhibir la activación alternativa de macrófagos y la diferenciación de fibrocitos. Además, PTX3 interactúa con proteínas de la matriz extracelular (proteína 6 inducida por TNF-α e inhibidor de la inter-α-tripsina), fibrinógeno o fibrina y plasminógeno, lo que explica su participación en la remodelación de la matriz en el daño y reparación tisular (44).
Las concentraciones plasmáticas de PTX3 aumentan rápidamente durante una serie de infecciones y se asocian positivamente con la gravedad de la enfermedad y el riesgo de muerte(45-48), como se analiza a continuación para Covid-19. Los niveles plasmáticos de PTX3 también reflejan la gravedad de las enfermedades vasculares inflamatorias que van desde la aterosclerosis hasta la vasculitis(49).
En condiciones inflamatorias, los niveles de PTX3 aumentan antes que los niveles de proteína C reactiva, como se muestra en la Figura 1B. Las diferentes cinéticas de aparición de PTX3 y proteína C reactiva bien pueden reflejar sus diferentes fuentes celulares. PTX3 se almacena en gránulos de neutrófilos, listos para su liberación, y PTX3 sirve como un gene temprano inmediato en los tejidos, con su transcripción inducida por agonistas de TLR y citocinas inflamatorias.
Por el contrario, la producción de proteína C reactiva en el hígado está aguas abajo de la cascada de citoquinas, lo que da como resultado una aparición más tardía.
Los polimorfismos genéticos de PTX3 y SAP se han asociado con la susceptibilidad a las infecciones fúngicas y bacterianas (38,48,50,51) y a la formación de granulomas pulmonares en la sarcoidosis a través de la regulación del complemento(52). Por lo tanto, los resultados de los análisis mecánicos, la evidencia de ratones dirigidos por genes y los hallazgos de los análisis de polimorfismos genéticos humanos son consistentes con la opinión de que el trío de pentraxina de proteína C reactiva-SAP-PTX3 juega un papel en la amplificación de la resistencia innata a patógenos seleccionados y en la regulación de la remodelación de tejidos.
AMILOIDE A EN SUERO
Los miembros de la familia SAA son las principales proteínas de fase aguda en humanos. En humanos, cuatro genes codifican diferentes miembros de la familia; SAA1 y SAA2 son proteínas típicas de fase aguda derivadas del hígado y se denominan colectivamente A-SAA.
La síntesis extrahepática de A-SAA en las articulaciones explica los altos niveles de SAA en el líquido sinovial, además de los altos niveles sistémicos en plasma (53).
En el intestino delgado, la interleucina-22 induce SAA en las células epiteliales y promueve la diferenciación local de células T auxiliares (17) y función efectora, favoreciendo la integridad de la barreras de los tejidos (mucosas respiratoria e intestinal y piel)(54).
Se han informado actividades funcionales similares a las citoquinas para los miembros de la familia SAA, incluida la quimiotaxis causada por la interacción directa con los receptores de péptido formilo acoplados a proteína G. Además, el receptor Scavenger B-I (CD36) actúa como un receptor SAA endocítico y participa en las funciones inmunitarias e inflamatorias mediadas por SAA.
Según se informa, el A-SAA también induce una desviación similar a M2 (antiinflamatoria) de los macrófagos y opsoniza las bacterias patógenas gramnegativas, promoviendo su eliminación y resistencia innata a las infecciones (55).
Debido al aumento masivo de sus concentraciones plasmáticas durante la inflamación, el A-SAA se ha utilizado como marcador en varias afecciones inflamatorias, como la artritis reumatoide, las enfermedades cardiovasculares, el cáncer y las infecciones, incluido el síndrome respiratorio agudo severo por infección por SARS-CoV -2 infección (30,53,56).
Concentraciones plasmáticas altas de SAA a largo plazo o recurrentes (p. ej., debido a tuberculosis o artritis reumatoide) en asociación con variantes alélicas de SAA1 u otros factores desconocidos pueden conducir a amiloidosis amiloide A (AA), una condición causada por la acumulación de fibrillas AA en varios órganos, incluidos los riñones, el bazo y el hígado, lo que afecta su función.
Las fibrillas AA se forman como consecuencia del plegamiento de la proteína AA truncada, C-terminal derivada de SAA en láminas β extremadamente hidrofóbicas, que se agregan en oligómeros, lo que genera fibrillas insolubles resistentes a la proteólisis (57).
EL SISTEMA DEL COMPLEMENTO
El sistema del complemento es un actor central conservado evolutivamente en la inmunidad innata humoral. Consta de aproximadamente 50 moléculas solubles, en su mayoría producidas por el hígado y que normalmente se encuentran en la circulación, y receptores asociados a células, que son expresados por varios tipos de células (29,58).
El hígado es el sitio principal para la síntesis de la mayoría de las moléculas del complemento. Entre ellos, tanto las moléculas activadoras (C3, C4, C9 y factor B) como los reguladores negativos (inhibidor de C1 y C4BP) aumentan durante una reacción de fase aguda, lo que subraya la importancia de activar respuestas balanceadas mediadas por el complemento.
Sin embargo, su síntesis aumenta modestamente en comparación con la de las principales moléculas de reacción de fase aguda y alcanza su punto máximo en puntos de tiempo tardíos (Figura 1B).
Además de los hepatocitos, otros tipos de células, incluidos monocitos, macrófagos, células endoteliales, fibroblastos y adipocitos, pueden ser fuentes locales de proteínas del complemento como C1q, C3 y C5 (29) (Figura 3B).
LECTINA DE UNIÓN A MANOSA (MBL)
La MBL es una lectina plasmática de tipo C derivada del hígado, una clase de moléculas de reconocimiento de patrones compuestas por un dominio de lectina de tipo Ca2+ (también llamado dominio de reconocimiento de carbohidratos) y un dominio similar al colágeno (59), que actúa como una molécula de reconocimiento con alta afinidad por manosa y N-acetil glucosamina expuesta en microbios.
La MBL interactúa con estos restos de carbohidrato a través del dominio de la lectina, opsonizando a los patógenos para la fagocitosis y provocando la activación de las serina proteasas asociadas a la MBL, iniciando así la cascada del complemento a través de la vía de la lectina.
Dentro de MBL (2), el gene que codifica la MBL humana, se han encontrado tres mutaciones puntuales en el exón 1, que codifica la región colágena de la MBL; además, se han encontrado varios polimorfismos en la región promotora. Estas mutaciones y polimorfismos afectan la función y concentración plasmática de la molécula.
La combinación de los haplotipos promotores y las mutaciones estructurales da como resultado la deficiencia de MBL, que ocurre en aproximadamente el 25% de las personas y se asocia con una mayor susceptibilidad a infecciones seleccionadas, particularmente en niños con inmunodeficiencia primaria o secundaria (60).
La MBL se definió originalmente como una proteína de fase aguda sobre la base de la regulación positiva de MBL2 en muestras de biopsia hepática de pacientes con afecciones inflamatorias. Sin embargo, estudios posteriores han demostrado que en la mayoría de las personas con mutaciones codificantes, la MBL no está regulada al alza en la fase aguda de las enfermedades infecciosas.
Por ejemplo, en estudios con pacientes con sepsis o neumonía, la MBL se comportó como una proteína de fase aguda positiva o negativa o no cambió durante la hospitalización, dependiendo su comportamiento principalmente del genotipo del exón 1 y del promotor (61,62) y posiblemente de otros polimorfismos de un solo nucleótido en las regiones reguladoras (22).
PROTEÍNAS DE FASE AGUDA Y HOMEOSTASIS DEL HIERRO
Varias proteínas de fase aguda están implicadas en el metabolismo del hierro, un nutriente necesario para una serie de funciones de la célula huésped, así como para el crecimiento de patógenos microbianos.
Las funciones generales de las proteínas de fase aguda en el metabolismo del hierro incluyen la unión al nutriente, evitando así que los patógenos utilicen el hierro libre circulante y la retención de hierro dentro de las células. Por lo tanto, la compleja regulación del metabolismo del hierro da como resultado una resistencia metabólica a patógenos seleccionados.
Las proteínas de fase aguda involucradas en el control del hierro libre incluyen la hormona peptídica circulante hepcidina, ferritina, haptoglobina y hemopexina, que están reguladas al alza en la reacción de fase aguda, mientras que la transferrina es una proteína de fase aguda negativa que está regulada a la baja durante la fase aguda (tabla 1). La hepcidina se une a la proteína transmembrana ferroportina y regula la liberación de hierro de las células al plasma.
La ferritina normalmente refleja directamente los niveles de hierro en la sangre; sin embargo, a diferencia de la anemia por deficiencia de hierro, la anemia asociada con enfermedades inflamatorias crónicas se caracteriza por niveles de ferritina más altos de lo normal debido a su inducción por la reacción de fase aguda. De hecho, se observa una alta concentración plasmática de ferritina en pacientes con afecciones inflamatorias patológicas graves, incluido el síndrome de activación de macrófagos, shock séptico y Covid-19, en los que la ferritina se usa como marcador de gravedad y pronóstico (ver más abajo).
La haptoglobina y la hemopexina son proteínas de fase aguda que actúan como secuestrantes solubles de hemoglobina libre y hemo, respectivamente.
El hemo libre es altamente tóxico porque es una fuente de hierro redox activo y tiene la capacidad de intercalarse en las membranas lipídicas, promoviendo la peroxidación lipídica.
La regulación ascendente de haptoglobina y hemopexina en reacciones de fase aguda favorece la protección contra el estrés oxidativo mediado por hemo, la pérdida de hierro en condiciones inflamatorias asociadas con hemólisis e infecciones al prevenir la utilización de hierro por patógenos.
PROTEÍNAS DE FASE AGUDA, COAGULACIÓN Y REPARACIÓN DE TEJIDOS
Varias proteínas de fase aguda están relacionadas con la cascada de la coagulación. El fibrinógeno y sus productos de degradación aguas abajo (dímero D y otros productos de degradación de fibrina) se utilizan ampliamente como marcadores de diagnóstico en afecciones inflamatorias, incluida la COVID-19. La coagulación y la reparación de tejidos son procesos estrictamente conectados.
La malla de fibrina formada aguas abajo de la cascada de coagulación sirve como matriz provisional esencial para la reparación de tejidos. Su eliminación oportuna mediante fibrinolisis es un requisito previo para los pasos posteriores en la maduración de la matriz.
La reacción de fase aguda alimenta los componentes involucrados en la coagulación (p. ej., fibrinógeno) y la formación de matriz extracelular (fibronectina) (Tabla 1). PTX3, a diferencia de su proteína C reactiva relativa, participa en una interacción tripartita con el fibrinógeno y el plasminógeno, promoviendo la degradación oportuna de la malla de fibrina provisional y la subsiguiente reparación del tejido (44). Además de los componentes de la matriz extracelular, los inhibidores de las enzimas proteolíticas (p. ej., α1 -antitripsina, α2-macroglobulina y α1-glucoproteína ácida) se producen durante la reacción de fase aguda y estos inhibidores pueden limitar el daño tisular. Por ejemplo, la α1-antitripsina tiene funciones protectoras del huésped en la autoinmunidad y la infección (31,63).
Las proteínas de la matriz extracelular, incluidos el fibrinógeno y la fibronectina, se unen a los microbios y facilitan su eliminación por los fagocitos. La función ancestral de las moléculas que contienen el dominio de fibrinógeno era la defensa (25). Por lo tanto, la producción de algunas proteínas de la matriz extracelular durante la inflamación sistémica se encuentra en la intersección de la reparación tisular y la inmunidad innata.
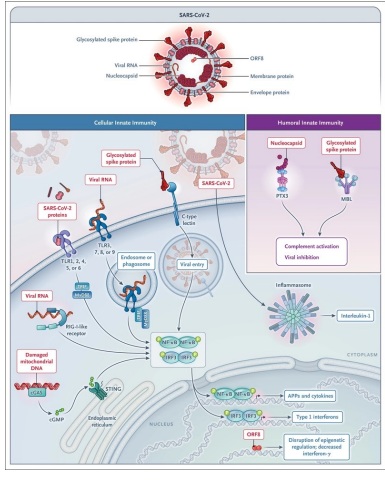
COVID-19
El reconocimiento inmunitario innato del SARS-CoV-2 actúa como una primera línea fundamental de resistencia, desencadena la inmunidad adaptativa e impulsa los efectos inmunopatológicos de la infección(64).
Los sensores celulares involucrados en la respuesta innata al SARS-CoV-2 incluyen el tipo C de membrana, lectinas que reconocen la proteína espiga (65); TLR3, TLR7 y TLR8 endosómicos, que reconocen los RNA virales; la vía citoplasmática de GMP-AMP sintasa cíclica (cGAS)-STING; y el inflamasoma (Figura 4). Se ha demostrado recientemente que el marco de lectura abierto 8 (ORF8) codificado por el SARS-CoV-2 inhibe la producción de interferón a través de mecanismos epigenéticos (66).
Los componentes del SARS-CoV-2 son reconocidos por proteínas de fase aguda seleccionadas. La MBL se une a la proteína espiga de todas las variantes probadas y tiene actividad antiviral (22). Además, activa la vía de la lectina del complemento, lo que posiblemente contribuya a los efectos inmunopatológicos en la enfermedad avanzada. PTX3, a diferencia de la proteína C reactiva y SAP, se une a la nucleoproteína viral(22 ) pero la función real in vivo de esta interacción no ha sido definida.
Aunque la importancia clínica del reconocimiento del virus por proteínas de fase aguda seleccionadas aún no se ha dilucidado por completo, estas moléculas han servido como herramientas de diagnóstico invaluables durante la pandemia, en contextos que van desde clínicas ambulatorias hasta unidades de cuidados intensivos (UCI) (Tabla 1).
La proteína C reactiva, la procalcitonina y la ferritina se han utilizado ampliamente y, en la mayoría de los estudios, las altas concentraciones plasmáticas en el momento del ingreso al hospital se han asociado con enfermedad grave y supervivencia deficiente (11-14).
La concentración de dímero D corriente abajo del fibrinógeno se correlacionó con áreas de hipoperfusión en pacientes con síndrome de dificultad respiratoria aguda, un hallazgo compatible con enfermedad tromboembólica, y se ha asociado con una mayor mortalidad.
Se ha descubierto que la anemia y un aumento de la relación ferritina:transferrina predicen el ingreso en la UCI y la recepción de ventilación mecánica (24).La concentración de componentes del complemento aumenta en pacientes con Covid-19, un hallazgo consistente con el papel de esta vía en los efectos inmunopatológicos(20).
La vía del complemento se ha convertido en una diana terapéutica en el Covid-19, con resultados preliminares alentadores en pequeños estudios de cohortes que mostraron una reacción de fase aguda reducida, actividad de trombina reducida y generación de trampa extracelular de neutrófilos reducida en asociación con la inhibición del complemento (21).
En una serie de estudios independientes basados en inmunoensayos convencionales (16,17,68-70) o enfoques proteómicos (71), PTX3 se ha convertido en un fuerte marcador pronóstico y predictor independiente de muerte dentro de los 28 días en pacientes hospitalizados.
Se descubrió que PTX3 se expresa en células mieloides en sangre periférica y pulmones y en células endoteliales pulmonares en pacientes con Covid-19 (16). La fuerte importancia pronóstica independiente de PTX3, que es mejor que la de la proteína C reactiva, interleucina-6, ferritina, o d-dímero, puede reflejar una integración de la activación de células endoteliales mieloides y microvasculares.
La selección de pacientes para diferentes terápias en diferentes etapas de la enfermedad y su seguimiento siguen siendo desafíos formidables. Las elevaciones en los niveles de proteína C reactiva combinadas con la determinación de la necesidad de oxígeno suplementario se han utilizado para seleccionar pacientes que pueden beneficiarse de la terápia anti-interleucina-6 (72).
En un estudio pequeño (que involucró a 30 pacientes), la respuesta al tratamiento con un anticuerpo monoclonal anti-interleucina-6 (siltuximab) se midió con el uso de una variedad de biomarcadores.
Los niveles de proteína C reactiva se redujeron independientemente del beneficio clínico, lo que refleja la inhibición de la producción de esta proteína de fase aguda en el hígado, no relacionada con la inflamación del tejido. Por el contrario, la PTX3 y la interleucina-8, que se producen en los tejidos, se correlacionaron mejor con la respuesta clínica (68).
La predicción de la progresión de la enfermedad representa un santo grial para una intervención oportuna. Se encontró que una firma de bajo costo que incluía proteína C reactiva como indicador de inflamación sistémica, PTX3 como correlato de reacción tisular y lactato deshidrogenasa como indicador de daño celular y tisular, se correlacionó con la gravedad de las lesiones en la tomografía computarizada y la progresión posterior de la enfermedad en pacientes con covid-19 pauci sintomático (18).
La integración de la medición de baja tecnología y bajo costo de proteínas de fase aguda seleccionadas con firmas moleculares puede allanar el camino para el desarrollo de herramientas que permitan enfoques tempranos más personalizados para el paciente.
Las secuelas postagudas de Covid-19 (PASC), también conocidas como “ Long Covid ”, son un desafío para los pacientes y para los sistemas de atención médica.
La patogénesis de PASC es compleja y depende de varios factores impulsores, incluida la persistencia del SARS-CoV-2 en diferentes órganos; reactivación y respuesta a virus no relacionados, como el virus de Epstein-Barr; autoinmunidad; inflamación sostenida; trombosis microvascular y los efectos de las vacunas basadas en mRNA (73-75).
La fatiga, la debilidad muscular y la intolerancia al ejercicio se encuentran entre los síntomas más frecuentes del Long Covid.
Este cuadro clínico recuerda a una condición conocida como síndrome de fatiga crónica o encefalomielitis miálgica, que ocurre después de infecciones virales, en las que las proteínas de fase aguda han surgido como correlatos de la actividad de la enfermedad (73,76).
En un estudio proteómico reciente destinado a definir un biomarcador asociado con el desarrollo posterior de PASC, un conjunto de proteínas de fase aguda, incluida la proteína C reactiva y las moléculas involucradas en el metabolismo del hierro, emergieron como parte de una firma de inflamación y respuesta al estrés predictiva de Long Covid (77). Perturbaciones profundas de la función de células mieloides se observaron 8 meses después de Covid-19 leve a moderado .
Un conjunto de biomarcadores (interferón-β, interferón-γ, interferón-λ, interleucina-6 y PTX3) se asoció con PASC(19). Los límites del universo del Long Covid y la diversidad de la afectación de órganos siguen estando mal definidos. Los cambios en los niveles de proteína de fase aguda junto con las firmas emergentes (74,78), pueden ayudar a definir los límites reales de este universo, su diversidad y el pronóstico de la afectación de órganos.
Comentarios finales
Desde el descubrimiento de la proteína C reactiva, las proteínas de fase aguda han sido herramientas invaluables en una amplia gama de enfermedades, incluidas la Covid-19 y el Long Covid (11-14,16), lo que apunta a la inflamación como una metanarrativa de la medicina en presente y en el futuro previsible (10,26).
Las proteínas de fase aguda han emergido como espectadores más que inocentes de la inflamación aguda y crónica. Muchas de estas moléculas reconocen fracciones microbianas y células o tejidos dañados. Estas moléculas promueven la eliminación de microbios y células muertas activando y regulando la cascada del complemento y mediando la actividad opsónica (Fifura 3)..
El aumento de la producción de moléculas de matriz (fibrinógeno y fibronectina) e inhibidores de la proteasa durante la respuesta de fase aguda puede verse como un mecanismo general para promover la reparación tisular. Además, los cambios en el metabolismo del hierro tienen amplias implicaciones a nivel sistémico (resistencia metabólica) y celular (79). Por lo tanto, las proteínas de fase aguda y, en general, la respuesta de fase aguda, son un componente esencial de la inmunidad innata humoral, que promueve la resistencia a los antimicrobianos y la reparación de tejidos.
El reconocimiento de que algunas proteínas de fase aguda son más que biomarcadores plantea la posibilidad de que puedan representar herramientas u objetivos terapéuticos. SAP se une a todas las formas de fibrillas de amiloide y es un objetivo terapéutico en la amiloidosis y la neurodegeneración (34,42,80).
Sin embargo, sobre la base de su efecto inhibidor sobre la diferenciación de fibrocitos, SAP ha entrado en evaluación clínica para el tratamiento de la fibrosis pulmonar idiopática (43).
Los polimorfismos genéticos en los loci SAP y PTX3 y la evidencia de estudios preclínicos apuntan al potencial terapéutico de estas moléculas para las infecciones por aspergillus, que representan un desafío clínico importante (38,48). Se ha administrado MBL a pacientes con deficiencias genéticas (81) y se ha demostrado recientemente que MBL reconoce la proteína espiga de las variantes conocidas del SARS-CoV-2 y puede mediar la resistencia contra el SARS-CoV-2 (22). Por lo tanto, la genética humana, la seguridad y los hallazgos preclínicos exigen esfuerzos para explorar el potencial de las proteínas de fase aguda para futuras aplicaciones terapéuticas.
Los enfoques integrales que aprovechan la tecnología de punta han identificado firmas candidatas asociadas con el riesgo y el curso clínico de Covid-19 (19,74,77,78), y algunas de las moléculas discutidas aquí son parte de estas firmas. La integración de biomarcadores clásicos validados en firmas emergentes y su evaluación rigurosa en grandes estudios de población con tecnología sostenible prometen un «regreso a la moda» para las proteínas de fase aguda 100 años después de su descubrimiento inicial (6,7).
Referencias Bibliográficas
- Medzhitov R. The spectrum of inflammatory responses. Science 2021;374:1070-1075.
- Nathan C. Nonresolving inflammation redux. Immunity 2022;55:592-605.
- Gitlin JD, Colten HR. Molecular biology of the acute phase plasma proteins. In: Pick E, Landy M, eds. Lymphokines. Vol. 14. San Diego: Academic Press, 1987:123-153.
- Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 1999;340:448-454.
- Dinarello CA. Interleukin-1 and the pathogenesis of the acute-phase response. N Engl J Med 1984;311:1413-1418.
- Tillett WS, Francis T. Serological reactions in pneumonia with a nonprotein somatic fraction of pneumococcus. J Exp Med 1930;52:561-571.
- Abernethy TJ, Avery OT. The occurrence during acute infections of a protein not normally present in the blood: I. Distribution of the reactive protein in patients’ sera and the effect of calcium on the flocculation reaction with C polysaccharide of pneumococcus. J Exp Med 1941;73:173-182.
- Ridker PM, Hennekens CH, Buring JE, Rifai N. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women. N Engl J Med 2000;342:836-843.
- Hansson GK, Libby P. The immune response in atherosclerosis: a double-edged sword. Nat Rev Immunol 2006;6:508-519.
- Furman D, Campisi J, Verdin E, et al. Chronic inflammation in the etiology of disease across the life span. Nat Med 2019;25:1822-1832.
- Danwang C, Endomba FT, Nkeck JR, Wouna DLA, Robert A, Noubiap JJ. A meta-analysis of potential biomarkers associated with severity of coronavirus disease 2019 (COVID-19). Biomark Res 2020;8:37-37.
- Tian W, Jiang W, Yao J, et al. Predictors of mortality in hospitalized COVID-19 patients: a systematic review and meta-analysis. J Med Virol 2020;92:1875-1883.
- Ji P, Zhu J, Zhong Z, et al. Association of elevated inflammatory markers and severe COVID-19: a meta-analysis. Medicine (Baltimore) 2020;99(10)e23315-e23315.
- Cecconi M, Piovani D, Brunetta E, et al. Early predictors of clinical deterioration in a cohort of 239 patients hospitalized for Covid-19 infection in Lombardy, Italy. J Clin Med 2020;9:1548-1548.
- Zinellu A, Paliogiannis P, Carru C, Mangoni AA. Serum amyloid A concentrations, COVID-19 severity and mortality: an updated systematic review and meta-analysis. Int J Infect Dis 2021;105:668-674.
- Brunetta E, Folci M, Bottazzi B, et al. Macrophage expression and prognostic significance of the long pentraxin PTX3 in COVID-19. Nat Immunol 2021;22:19-24.
- Lapadula G, Leone R, Bernasconi DP, et al. Long pentraxin 3 (PTX3) levels predict death, intubation and thrombotic events among hospitalized patients with COVID-19. Front Immunol 2022;13:933960-933960.
- Folci M, Brunetta E, Lanza E, et al. A PTX3/LDH/CRP signature correlates with lung injury CTs scan severity and disease progression in paucisymptomatic COVID-19. September 29, 2021 (https://www.medrxiv.org/content/10.1101/2021.09.29.21264061v1. opens in new tab
). - Phetsouphanh C, Darley DR, Wilson DB, et al. Immunological dysfunction persists for 8 months following initial mild-to-moderate SARS-CoV-2 infection. Nat Immunol 2022;23:210-216.
- Risitano AM, Mastellos DC, Huber-Lang M, et al. Complement as a target in COVID-19? Nat Rev Immunol 2020;20:343-344.
- Skendros P, Germanidis G, Mastellos DC, et al. Complement C3 inhibition in severe COVID-19 using compstatin AMY-101. Sci Adv 2022;8(33):eabo2341-eabo2341.
- Stravalaci M, Pagani I, Paraboschi EM, et al. Recognition and inhibition of SARS-CoV-2 by humoral innate immunity pattern recognition molecules. Nat Immunol 2022;23:275-286.
- Thurner L, Kessel C, Fadle N, et al. IL-1RA antibodies in myocarditis after SARS-CoV-2 vaccination. N Engl J Med 2022;387:1524-1527.
- Bellmann-Weiler R, Lanser L, Barket R, et al. Prevalence and predictive value of anemia and dysregulated iron homeostasis in patients with COVID-19 infection. J Clin Med 2020;9:2429-2429.
- Bottazzi B, Doni A, Garlanda C, Mantovani A. An integrated view of humoral innate immunity: pentraxins as a paradigm. Annu Rev Immunol 2010;28:157-183.
- Mantovani A, Dinarello CA, Molgora M, Garlanda C. Interleukin-1 and related cytokines in the regulation of inflammation and immunity. Immunity 2019;50:778-795.
- Gabay C, Smith MF, Eidlen D, Arend WP. Interleukin 1 receptor antagonist (IL-1Ra) is an acute-phase protein. J Clin Invest 1997;99:2930-2940.
- Ehlting C, Wolf SD, Bode JG. Acute-phase protein synthesis: a key feature of innate immune functions of the liver. Biol Chem 2021;402:1129-1145.
- Reichhardt MP, Meri S. Intracellular complement activation — an alarm raising mechanism? Semin Immunol 2018;38:54-62.
- De Buck M, Gouwy M, Wang JM, et al. Structure and expression of different serum amyloid A (SAA) variants and their concentration-dependent functions during host insults. Curr Med Chem 2016;23:1725-1755.
- Bai X, Bai A, Tomasicchio M, et al. α1-Antitrypsin binds to the glucocorticoid receptor with anti-inflammatory and antimycobacterial significance in macrophages. J Immunol 2022;209:1746-1759.
- Lin Y, Rajala MW, Berger JP, Moller DE, Barzilai N, Scherer PE. Hyperglycemia-induced production of acute phase reactants in adipose tissue. J Biol Chem 2001;276:42077-42083.
- Langhans C, Weber-Carstens S, Schmidt F, et al. Inflammation-induced acute phase response in skeletal muscle and critical illness myopathy. PLoS One 2014;9(3):e92048-e92048.
- Pepys MB. The pentraxins 1975–2018: serendipity, diagnostics and drugs. Front Immunol 2018;9:2382-2382.
- Garlanda C, Bottazzi B, Magrini E, Inforzato A, Mantovani A. PTX3, a humoral pattern recognition molecule, in innate immunity, tissue repair, and cancer. Physiol Rev 2018;98:623-639.
- Jaillon S, Peri G, Delneste Y, et al. The humoral pattern recognition receptor PTX3 is stored in neutrophil granules and localizes in extracellular traps. J Exp Med 2007;204:793-804.
- Garlanda C, Hirsch E, Bozza S, et al. Non-redundant role of the long pentraxin PTX3 in anti-fungal innate immune response. Nature 2002;420:182-186.
- Doni A, Parente R, Laface I, et al. Serum amyloid P component is an essential element of resistance against Aspergillus fumigatus. Nat Commun 2021;12:3739-3739.
- Bickerstaff MC, Botto M, Hutchinson WL, et al. Serum amyloid P component controls chromatin degradation and prevents antinuclear autoimmunity. Nat Med 1999;5:694-697.
- Lu J, Marnell LL, Marjon KD, Mold C, Du Clos TW, Sun PD. Structural recognition and functional activation of FcgammaR by innate pentraxins. Nature 2008;456:989-992.
- Wensley F, Gao P, Burgess S, et al. Association between C reactive protein and coronary heart disease: mendelian randomisation analysis based on individual participant data. BMJ 2011;342:d548-d548.Bodin K, Ellmerich S, Kahan MC, et al. Antibodies to human serum amyloid P component eliminate visceral amyloid deposits. Nature 2010;468:93-97.
- Raghu G, van den Blink B, Hamblin MJ, et al. Long-term treatment with recombinant human pentraxin 2 protein in patients with idiopathic pulmonary fibrosis: an open-label extension study. Lancet Respir Med 2019;7:657-664.
- Doni A, Musso T, Morone D, et al. An acidic microenvironment sets the humoral pattern recognition molecule PTX3 in a tissue repair mode. J Exp Med 2015;212:905-925.
- Caironi P, Masson S, Mauri T, et al. Pentraxin 3 in patients with severe sepsis or shock: the ALBIOS trial. Eur J Clin Invest 2017;47:73-83.
- Muller B, Peri G, Doni A, et al. Circulating levels of the long pentraxin PTX3 correlate with severity of infection in critically ill patients. Crit Care Med 2001;29:1404-1407.
- Lee YT, Gong M, Chau A, et al. Pentraxin-3 as a marker of sepsis severity and predictor of mortality outcomes: a systematic review and meta-analysis. J Infect 2018;76:1-10.
- Cunha C, Aversa F, Lacerda JF, et al. Genetic PTX3 deficiency and aspergillosis in stem-cell transplantation. N Engl J Med 2014;370:421-432.
- Jenny NS, Arnold AM, Kuller LH, Tracy RP, Psaty BM. Associations of pentraxin 3 with cardiovascular disease and all-cause death: the Cardiovascular Health Study. Arterioscler Thromb Vasc Biol 2009;29:594-599.
- Wójtowicz A, Lecompte TD, Bibert S, et al. PTX3 polymorphisms and invasive mold infections after solid organ transplant. Clin Infect Dis 2015;61:619-622.
- Jaillon S, Moalli F, Ragnarsdottir B, et al. The humoral pattern recognition molecule PTX3 is a key component of innate immunity against urinary tract infection. Immunity 2014;40:621-632.
- Gonçales RA, Bastos HN, Duarte-Oliveira C, et al. Pentraxin 3 inhibits complement-driven macrophage activation to restrain granuloma formation in sarcoidosis. Am J Respir Crit Care Med 2022;206:1140-1152.
- Connolly M, Marrelli A, Blades M, et al. Acute serum amyloid A induces migration, angiogenesis, and inflammation in synovial cells in vitro and in a human rheumatoid arthritis/SCID mouse chimera model. J Immunol 2010;184:6427-6437.
- Sano T, Huang W, Hall JA, et al. An IL-23R/IL-22 circuit regulates epithelial serum amyloid A to promote local effector Th17 responses. Cell 2015;163:381-393.
- Shah C, Hari-Dass R, Raynes JG. Serum amyloid A is an innate immune opsonin for Gram-negative bacteria. Blood 2006;108:1751-1757.
- Fyfe AI, Rothenberg LS, DeBeer FC, Cantor RM, Rotter JI, Lusis AJ. Association between serum amyloid A proteins and coronary artery disease: evidence from two distinct arteriosclerotic processes. Circulation 1997;96:2914-2919.
- Westermark GT, Fändrich M, Westermark P. AA amyloidosis: pathogenesis and targeted therapy. Annu Rev Pathol 2015;10:321-344.
- Hajishengallis G, Reis ES, Mastellos DC, Ricklin D, Lambris JD. Novel mechanisms and functions of complement. Nat Immunol 2017;18:1288-1298.
- Holmskov U, Thiel S, Jensenius JC. Collections and ficolins: humoral lectins of the innate immune defense. Annu Rev Immunol 2003;21:547-578.
- Koch A, Melbye M, Sørensen P, et al. Acute respiratory tract infections and mannose-binding lectin insufficiency during early childhood. JAMA 2001;285:1316-1321.
- Dean MM, Minchinton RM, Heatley S, Eisen DP. Mannose binding lectin acute phase activity in patients with severe infection. J Clin Immunol 2005;25:346-352.
- Herpers BL, Endeman H, de Jong BAW, et al. Acute-phase responsiveness of mannose-binding lectin in community-acquired pneumonia is highly dependent upon MBL2 genotypes. Clin Exp Immunol 2009;156:488-494.
- Ebert M, Jerke U, Eulenberg-Gustavus C, et al. Protective α1-antitrypsin effects in autoimmune vasculitis are compromised by methionine oxidation. J Clin Invest 2022;132(23):e160089-e160089.
- Merad M, Blish CA, Sallusto F, Iwasaki A. The immunology and immunopathology of COVID-19. Science 2022;375:1122-1127.
- Lempp FA, Soriaga LB, Montiel-Ruiz M, et al. Lectins enhance SARS-CoV-2 infection and influence neutralizing antibodies. Nature 2021;598:342-347.
- Kee J, Thudium S, Renner DM, et al. SARS-CoV-2 disrupts host epigenetic regulation via histone mimicry. Nature 2022;610:381-388.
- Grasselli G, Tonetti T, Protti A, et al. Pathophysiology of COVID-19-associated acute respiratory distress syndrome: a multicentre prospective observational study. Lancet Respir Med 2020;8:1201-1208.Gritti G, Raimondi F, Bottazzi B, et al. Siltuximab downregulates interleukin-8 and pentraxin 3 to improve ventilatory status and survival in severe COVID-19. Leukemia 2021;35:2710-2714.
- Hansen CB, Sandholdt H, Møller MEE, et al. Prediction of respiratory failure and mortality in COVID-19 patients using long pentraxin PTX3. J Innate Immun 2022;14:493-501.
- Schirinzi A, Pesce F, Laterza R, et al. Pentraxin 3: potential prognostic role in SARS-CoV-2 patients admitted to the emergency department. J Infect 2021;82:84-123.Gutmann C, Takov K, Burnap SA, et al. SARS-CoV-2 RNAemia and proteomic trajectories inform prognostication in COVID-19 patients admitted to intensive care. Nat Commun 2021;12:3406-3406.
- van de Veerdonk FL, Giamarellos-Bourboulis E, Pickkers P, et al. A guide to immunotherapy for COVID-19. Nat Med 2022;28:39-50.
- Mantovani A, Morrone MC, Patrono C, et al. Long Covid: where we stand and challenges ahead. Cell Death Differ 2022;29:1891-1900.
- Su Y, Yuan D, Chen DG, et al. Multiple early factors anticipate post-acute COVID-19 sequelae. Cell 2022;185(5):881-895.e20.
- Pretorius E, Vlok M, Venter C, et al. Persistent clotting protein pathology in long COVID/post-acute sequelae of COVID-19 (PASC) is accompanied by increased levels of antiplasmin. Cardiovasc Diabetol 2021;20:172-172.
- Choutka J, Jansari V, Hornig M, Iwasaki A. Unexplained post-acute infection syndromes. Nat Med 2022;28:911-923.
- Captur G, Moon JC, Topriceanu CC, et al. Plasma proteomic signature predicts who will get persistent symptoms following SARS-CoV-2 infection. EBioMedicine 2022;85:104293-104293.
- Klein J, Wood J, Jaycox J, et al. Distinguishing features of long COVID identified through immune profiling. August 10, 2022 (https://www.medrxiv.org/content/10.1101/2022.08.09.22278592v1. opens in new tab
). - Cairo G, Recalcati S, Mantovani A, Locati M. Iron trafficking and metabolism in macrophages: contribution to the polarized phenotype. Trends Immunol 2011;32:241-247.
- Pepys MB, Dyck RF, de Beer FC, Skinner M, Cohen AS. Binding of serum amyloid P-component (SAP) by amyloid fibrils. Clin Exp Immunol 1979;38:284-293.
- Garred P, Pressler T, Lanng S, et al. Mannose-binding lectin (MBL) therapy in an MBL-deficient patient with severe cystic fibrosis lung disease. Pediatr Pulmonol 2002;33:201-207.