Ronald Palacios Castrillo
Aspectos destacados
- El estornudo y la tos están mediados por poblaciones sensoriales distintas
- Las neuronas sensoriales nasales que expresan MrgprC11 sirven como una población central de «estornudos»
- Las neuronas sensoriales de las vías respiratorias que expresan SST median la tos inducida químicamente
- Estornudos y la tos se transmiten y modulan por vías neuronales divergentes
Resumen
El estornudo y la tos son síntomas primarios de muchas infecciones virales respiratorias y alergias. Generalmente se asume que el estornudo y la tos involucran receptores sensoriales comunes y mecanismos de neurotransmisión molecular.
=> Recibir por Whatsapp las noticias destacadas
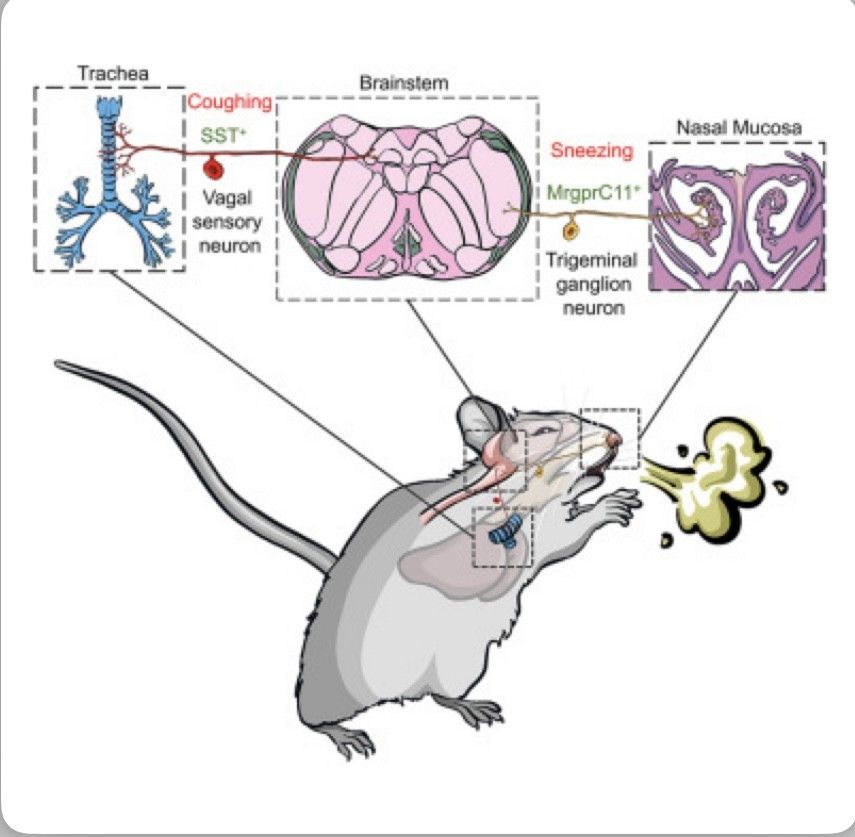
Aquí, Jiang,et.,al.,[CELL.DOI: 10.1016/j.cell.2024.08.009] muestran que la mucosa nasal está inervada por varias poblaciones discretas de neuronas sensoriales, pero solo una población (MrgprC11+MrgprA3−) media las respuestas del estornudo a una multitud de irritantes nasales, alérgenos y virus.
Aunque esta población también inerva la tráquea, no media la tos, como lo revela su modelo de tos recientemente establecido. En cambio, una población sensorial distinta (somatostatina [SST+]) media la tos pero no el estornudo, lo que revela una diferencia sensorial imprevista entre el estornudo y la tos.
A nivel de circuito, las señales del estornudo y la tos se transmiten y modulan por vías neuronales divergentes. En conjunto, este estudio revela la diferencia en los receptores sensoriales y los mecanismos de neurotransmisión/modulación entre los estornudos y la tos, ofreciendo objetivos farmacológicos neuronales para el manejo de los síntomas en las infecciones virales respiratorias y las alergias.
En Detalle
Las infecciones virales respiratorias (p. ej., influenza, resfriado común y COVID-19) con frecuencia inducen estornudos y tos al activar las fibras sensoriales primarias que inervan la nariz y las vías respiratorias inferiores, respectivamente.
Se cree que estornudar y toser, que se presume que fueron diseñados como mecanismos de defensa del huésped, protegen las vías respiratorias al expulsar patógenos, alérgenos e irritantes. Sin embargo, estos dos reflejos también pueden ser secuestrados por virus respiratorios para propagarse a nuevos huéspedes.
De hecho, las infecciones respiratorias se transmiten con mayor frecuencia a través de gotitas de aerosol que contienen virus generadas al estornudar o toser.
El estornudo es provocado por fibras sensoriales primarias que inervan la mucosa nasal. La mucosa nasal está densamente inervada por los axones periféricos de diversas neuronas sensoriales ubicadas en los ganglios trigéminos. Estas neuronas detectan estímulos mecánicos, térmicos y químicos a través de canales iónicos de membrana o receptores en sus axones periféricos y transmiten señales a través de sus axones centrales al tronco encefálico.
Las estimulaciones eléctricas del nervio etmoidal (que comprende fibras sensoriales nasales) desencadenan el reflejo del estornudo. Sin embargo, las neuronas sensoriales primarias muestran un alto grado de heterogeneidad en términos de patrones de inervación axonal, expresión genética, propiedades fisiológicas y funcionalidades.
Sigue sin estar claro qué población(es) de fibras sensoriales nasales dentro de los nervios etmoidales median el estornudo. Además, el estornudo puede ser provocado por virus respiratorios, alérgenos e irritantes que inducen diversas sensaciones nasales (p. ej., dolor y picazón) en humanos.
Esto plantea la pregunta adicional de si diferentes estímulos nasales inducen el estornudo a través de poblaciones discretas de neuronas sensoriales nasales o una población central común. Al igual que el estornudo, la tos es un reflejo respiratorio que se caracteriza por la expulsión convulsiva de aire, pero que se produce principalmente en las vías respiratorias inferiores.
Estos dos reflejos respiratorios pueden ser desencadenados por muchos patógenos, alérgenos e irritantes comunes de las vías respiratorias (p. ej., flujo de aire, capsaicina e histamina). Ambos reflejos sirven como mecanismos para expulsar agentes que podrían dañar las vías respiratorias. Por lo tanto, generalmente se supone que el estornudo y la tos involucran receptores sensoriales comunes.
Para comprobar esta suposición, es fundamental identificar los receptores sensoriales que median el estornudo y la tos. Sin embargo, es controvertido si los ratones tienen el reflejo de la tos.Los estudios sugieren que los ratones carecen del reflejo de la tos basándose en la observación de que los ratones anestesiados no muestran respuestas similares a la tos a los estímulos mecánicos aplicados al tracto respiratorio.
Por el contrario, estudios recientes muestran que la inhalación de amoníaco o dióxido de azufre induce respuestas similares a la tos en ratones despiertos. Sin embargo, el amoníaco y el dióxido de azufre irritan tanto el sistema olfativo como las vías respiratorias superiores e inferiores, e inducen cambios respiratorios amplios, lo que complica la interpretación de estos resultados.
En este estudio, Jiang,et.,al.,[CELL.DOI: 10.1016/j.cell.2024.08.009] demostraron que la mucosa nasal está inervada por múltiples poblaciones de neuronas sensoriales, pero el cribado funcional in vivo revela que solo una población (MrgprC11+MrgprA3−) media el estornudo.
Curiosamente, la misma población de neuronas sensoriales también inerva el tracto respiratorio inferior. Al desarrollar un modelo para la investigación de la tos, identificaron los patrones respiratorios y auditivos característicos de la tos en ratones, que son distintos de los de los estornudos.
Sin embargo, la infección por influenza y la tos inducida químicamente no fueron mediadas por neuronas MrgprC11+. En cambio, una población sensorial discreta (somatostatina [SST+]) media la tos pero no el estornudo.
Las señales de estornudo y tos son transmitidas y moduladas además por vías neuronales centrales divergentes. Nuestros hallazgos revelan una diferencia sensorial inesperada entre estornudar y toser, lo que ofrece objetivos neuronales distintos para el manejo de estornudos y tos en infecciones respiratorias y alergias.
El estornudo y la tos son síntomas primarios de muchas infecciones virales respiratorias y alergias. Son mecanismos de defensa diseñados para expulsar irritantes, alérgenos y patógenos de la nariz y las vías respiratorias inferiores, respectivamente.
En contraste con la suposición popular de que el estornudo y la tos son desencadenados por receptores sensoriales comunes,los autores identificaron poblaciones sensoriales discretas que median el estornudo y la tos, que difieren en patrones de inervación axonal, perfiles moleculares y funcionalidades.
Las neuronas sensoriales MrgprC11+ inervan densamente la mucosa nasal y median el estornudo, mientras que las neuronas SST+ inervan preferentemente las vías respiratorias inferiores y median la tos. Además, las neuronas SST+, en lugar de las neuronas MrgprC11+, expresan selectivamente los receptores para mediadores inflamatorios, como IL-31 y leucotrienos cisteinílicos, y muestran una sensibilidad única a la inflamación de las vías respiratorias.
Los estudios han demostrado la regulación positiva de los mediadores inflamatorios (p. ej., IL-31 y leucotrienos) en el asma y otras afecciones patológicas. Sería interesante investigar los efectos de la inflamación crónica de las vías respiratorias en la expresión genética, la inervación axonal y la excitabilidad neuronal de las neuronas de la tos SST+.
Esto abrirá una puerta al estudio de la tos patológica asociada con el asma, la COVID prolongada y la enfermedad pulmonar obstructiva crónica (EPOC).
Desde una perspectiva evolutiva, las distintas poblaciones neuronales de estornudos y tos pueden proporcionar una vigilancia sensorial complementaria y ventajas en la detección y la eliminación física de sustancias potencialmente dañinas.
Por ejemplo, muchos virus respiratorios (p. ej., influenza, rinovirus) inducen estornudos y tos, pero algunos virus respiratorios (p. ej., variantes tempranas del virus SARS-CoV-2 y el virus respiratorio sincitial) inducen principalmente tos.
La vigilancia sensorial dual por parte de las neuronas del estornudo y la tos proporciona un mecanismo más amplio y eficiente para detectar infecciones virales, especialmente cuando el virus escapa a una vigilancia sensorial.
Esto es particularmente importante ya que los virus respiratorios evolucionan rápidamente. Traducir estos hallazgos de ratones a humanos es importante.
Con respecto a las neuronas del estornudo MrgprC11+, la MrgprX1 de primates es sensible a los agonistas de MrgprC11 y es el ortólogo funcional de MrgprC11 de ratón. Curiosamente, MrgprX1 también se expresa de forma selectiva en las neuronas sensoriales de las fibras C tanto en humanos como en monos.
Las neuronas MrgprX1+ pueden ser activadas de forma robusta por la histamina en monos , lo que sugiere el papel potencial de estas neuronas en el estornudo. Sería interesante estudiar la inervación y las propiedades fisiológicas de las fibras sensoriales MrgprX1+ en la mucosa nasal humana en condiciones normales y patológicas.
Además, se generó una línea de ratones transgénicos en la que el receptor humano MrgprX1 se expresa en neuronas sensoriales MrgprC11+ de ratón, mientras que se eliminaron las Mrgprs endógenas de ratón.
Esta línea nos permite estudiar la función del receptor hMrgprX1 y las neuronas hMrgprX1+ en un modelo de ratón. Los resultados de estos estudios sentarán una base sólida para estudiar y tratar los estornudos en humanos.
Para las neuronas de la tos SST+, se realizarán estudios translacionales similares. La secuenciación unicelular de neuronas sensoriales humanas indica que la expresión de SST marca un grupo neuronal que también expresa las subunidades del receptor IL-31 (IL31RA y OSMR) y los receptores de histamina (HRH1), en consonancia con las poblaciones nociceptivas/pruriceptivas SST+ de ratones y macacos.
Sin embargo, a diferencia de las neuronas SST+ de ratón, las neuronas SST+ humanas expresan el péptido relacionado con el gen de la calcitonina CGRP (CALCA) y el receptor de serotonina HTR3A en lugar de HTR1F y no expresan el receptor 2 de leucotrieno cisteinílico (CYSLTR2).
La caracterización de la inervación de las fibras sensoriales SST+ y las propiedades fisiológicas en los tejidos de las vías respiratorias humanas en condiciones normales y patológicas ayudará a revelar su participación en la tos y a avanzar en nuestra comprensión de la neurobiología de la tos en humanos.
El tratamiento de las neuronas que producen estornudos o tos proporciona una estrategia segura y eficaz para el control de los síntomas en las alergias y las infecciones virales respiratorias.
En primer lugar, dado que esta estrategia silencia específicamente una población sensorial, no afectaría las funciones de otras poblaciones neuronales, células caliciformes, glándulas y epitelio de las vías respiratorias. Esto evitará los efectos secundarios no deseados que se asocian comúnmente con los antihistamínicos o corticosteroides convencionales, como la sequedad de las vías respiratorias, el sangrado y las infecciones.
La administración nasal o de las vías respiratorias de reactivos terapéuticos también minimiza los efectos secundarios sistémicos.
En segundo lugar, los estudios de prueba de concepto de silenciamiento de las neuronas que producen estornudos nasales utilizando una combinación de BAM y QX-314 han arrojado evidencia preclínica clave de la viabilidad y eficacia de esta estrategia terapéutica. La misma estrategia es aplicable al tratamiento de la tos.
Las neuronas SST+ de la tos pueden silenciarse mediante la administración intratraqueal de QX-314 con agonistas selectivos de las neuronas SST como Ly344864 en ratones o agonistas HTR3A en humanos.
Además, las neuronas SST+ humanas expresan selectivamente el receptor de IL-31, una citocina implicada en la fisiopatología de la dermatitis atópica y otros trastornos atópicos.
Sería interesante investigar las funciones de IL-31 y su receptor en la tos. Los ensayos clínicos indican que el anticuerpo monoclonal humanizado anti-IL-31RA (CIM331, nemolizumab) alivia significativamente el prurito en pacientes con dermatitis atópica. Debido a que la tos se asocia con frecuencia con picazón o irritación de las vías respiratorias, la aplicación de nemolizumab a la tos patológica podría ser explotada.
En conjunto, estos estudios revelan la base neural de los estornudos y la tos e identifican dianas farmacológicas para el manejo de los síntomas en las alergias y las infecciones virales respiratorias.