Ronald Palacios Castrillo
Este artículo de la revista NEJM comienza con una viñeta de un caso que destaca un problema clínico común. Luego se presenta la evidencia que respalda varias estrategias, seguida de una revisión de las pautas formales, cuando existen. El artículo termina con las recomendaciones clínicas de los autores Stewart,et.al.,[N Engl J Med 2024;391:1721-1733.DOI: 10.1056/NEJMcp2309623].
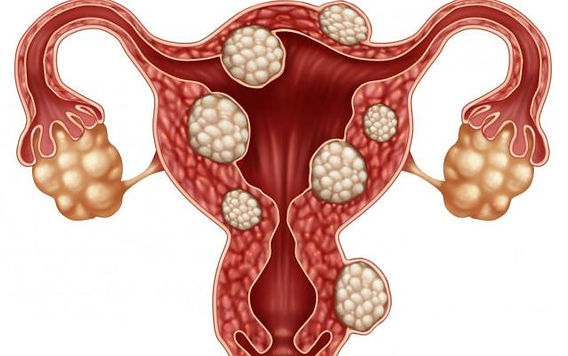
Una mujer negra embarazada de 33 años se presenta a su médico de atención primaria con sangrado menstrual abundante y distensión abdominal. Se observa que tiene anemia por deficiencia de hierro. La evaluación para talasemia y anemia de células falciformes es negativa. No tiene hematoquecia ni antecedentes familiares de cáncer de colon o enfermedad inflamatoria intestinal. Describe sus menstruaciones como regulares y mensuales, con una duración de 8 días y sin cambios a lo largo del tiempo. Utiliza ocho o nueve tampones por día durante los tres días más abundantes de su ciclo y ocasionalmente tiene accidentes menstruales. Está en un programa de doctorado y prevé buscar un embarazo en 2 años. La ecografía revela un útero agrandado con múltiples fibromas y ovarios normales. ¿Cómo trataría a esta paciente?
=> Recibir por Whatsapp las noticias destacadas
El problema clínico
Los fibromas uterinos (leiomiomas) son masas miometriales y son la principal indicación para la histerectomía. Los fibromas afectan del 70 al 80% de las personas con útero durante su vida.1. Hasta el 50% de las personas con fibromas tienen síntomas, que incluyen sangrado menstrual abundante y prolongado, fatiga asociada a anemia, presión pélvica y dolor menstrual y no menstrual. Los fibromas pueden causar compresión de las estructuras circundantes con los síntomas resultantes relacionados con la masa, que incluyen en el intestino (estreñimiento), la vejiga (frecuencia urinaria, urgencia o retención) y la vagina (relaciones sexuales dolorosas). El crecimiento lento de los fibromas uterinos es típico, aunque pueden producirse tanto encogimiento como estirones.2.
PUNTOS CLAVE FIBROMAS UTERINOS
Los fibromas uterinos son una enfermedad común del útero y son más comunes y más graves en las personas de etnia negra que en las de etnia blanca.
Los fibromas son una causa frecuente de sangrado menstrual abundante y están asociados con anemia por deficiencia de hierro.
Aunque la histerectomía sigue siendo el procedimiento más común para tratar los fibromas, las secuelas a largo plazo de la histerectomía sugieren que las terapias alternativas, como las terapias médicas, la embolización de la arteria uterina, la ablación por ultrasonidos focalizados y la ablación por radiofrecuencia, deberían usarse más ampliamente.
La terapia de combinación oral con antagonistas de la hormona liberadora de gonadotropina produce reducciones sustanciales en el sangrado menstrual abundante y los síntomas relacionados con la masa, con bajos riesgos de efectos secundarios hipogonadales y tromboembólicos. La morbilidad relacionada con los fibromas se ve agravada por la falta de detección y la atribución de sus síntomas a otras afecciones, como enfermedades gastrointestinales o hematológicas.
Debido al estigma asociado con hablar sobre la menstruación, muchas personas con menstruaciones largas o abundantes no saben que su experiencia es anormal. Las personas sintomáticas a menudo reciben un diagnóstico tardío. En un tercio de las pacientes, el diagnóstico puede demorar 5 años, y algunas pacientes esperan más de 8 años.3. Los retrasos en el diagnóstico afectan negativamente la fertilidad, la calidad de vida y el bienestar financiero[4,5], y en un estudio cualitativo, el 95% de las personas con fibromas sintomáticos informaron secuelas psicológicas, incluida la depresión, la preocupación, la ira y la angustia por la imagen corporal.6. El estigma y la vergüenza relacionados con la menstruación inhiben el debate, el estudio, la defensa y la innovación en este campo. Un total del 50 al 72% de las personas que reciben un diagnóstico de fibromas uterinos sobre la base de una ecografía no sabían previamente que tenían fibromas, lo que sugiere un papel potencial para una evaluación ecográfica más amplia de esta afección común.4.
La incidencia de los fibromas aumenta con la edad hasta la menopausia y es mayor entre las personas de etnia negra que entre las de etnia blanca[1,7]. Las personas de etnia negra tienen una aparición más temprana de los fibromas, un mayor riesgo acumulativo de síntomas y una mayor carga de enfermedad en general que las personas de otras etnias. Las personas de etnia negra también presentan una enfermedad más grave y tienen una mayor probabilidad de histerectomía y miomectomía quirúrgicas que las personas de etnia blanca.8. Además, las personas de etnia negra tienen más probabilidades que las personas de etnia blanca de preferir la terapia no invasiva y evitar la derivación a cirugía para evitar la posibilidad de una histerectomía[3,9,10].
El diagnóstico de los fibromas es sencillo con la ecografía pélvica, pero determinar a quién se debe realizar la prueba de detección no lo es y, por lo general, se realiza después de que los fibromas son grandes o las pacientes presentan síntomas. Los síntomas asociados con los fibromas pueden superponerse con los de los trastornos ovulatorios, la adenomiosis y la dismenorrea secundaria, así como con los de las afecciones gastrointestinales. Debido a que tanto los sarcomas como los fibromas se manifiestan como masas miometriales, a menudo con sangrado uterino anormal, surge la preocupación de que el diagnóstico de sarcoma uterino pueda pasarse por alto, a pesar de que este cáncer es relativamente raro (1 caso por cada 770 a 10 000 personas que presentan sangrado uterino anormal)[11]. Debido al mal pronóstico cuando este cáncer se propaga fuera del útero, la preocupación por el leiomiosarcoma no diagnosticado ha llevado a un aumento de las tasas de histerectomía y a una reducción del uso de abordajes mínimamente invasivos, lo que ha dado lugar a exponer a las pacientes a mayores riesgos de complicaciones de lo necesario[12,13].
Estrategias y evidencia
DIAGNÓSTICO Y EVALUACIÓN
La ecografía pélvica es el método de diagnóstico por imágenes más rentable para el diagnóstico de fibromas, dado que proporciona información sobre el tamaño, la ubicación y la cantidad de fibromas y puede descartar masas anexiales. La ecografía pélvica ambulatoria también está indicada para evaluar el sangrado uterino anormal, las masas pélvicas que se palpan durante el examen y los síntomas relacionados con la masa pélvica, como la presión y la distensión pélvica. La ecografía está limitada por una resolución menos precisa si el volumen uterino es mayor de 375 ml o si hay más de cuatro fibromas, una situación común[14]. La resonancia magnética es útil cuando se sospecha un sarcoma uterino y cuando se planifican alternativas a la histerectomía, en cuyo caso la información precisa sobre el tamaño, las características de la imagen y la ubicación es importante para los resultados[13]. Si se sospecha la presencia de fibromas submucosos u otras lesiones endometriales, la ecografía con infusión salina o la histeroscopia pueden ser útiles. La tomografía computarizada no es útil para los fibromas debido a la baja definición y la visualización imprecisa de los planos tisulares. En 2011, la Federación Internacional de Ginecología y Obstetricia publicó un sistema de clasificación de los fibromas para describir mejor la ubicación de los fibromas en relación con la cavidad uterina y la superficie serosa, más allá de los términos históricos de submucoso, intramural y subseroso, lo que permite una comunicación más clara y una planificación del tratamiento.15. Los tipos varían de 0 a 8, y los números más bajos indican fibromas más cercanos al endometrio. Los leiomiomas híbridos se indican con dos números separados por un guion; el primer número indica la relación del fibroma con el endometrio y el segundo indica la relación del fibroma con la serosa. Este sistema de categorización de los fibromas permite al médico adaptar aún más el diagnóstico y el tratamiento y mejorar la comunicación.
Tratamiento
ALTERNATIVAS MÉDICAS A LA HISTERECTOMÍA
Las hormonas anticonceptivas para controlar el sangrado menstrual abundante constituyen el primer paso en la mayoría de los algoritmos para el tratamiento del sangrado menstrual abundante relacionado con los miomas, a pesar de la evidencia de baja calidad. Los agentes antiinflamatorios no esteroides y el ácido tranexámico tomados durante las menstruaciones también se utilizan para limitar las menstruaciones abundantes, pero estos medicamentos tienen más evidencia de eficacia para las menstruaciones abundantes idiopáticas, una situación en la que las personas con miomas grandes o submucosos generalmente han sido excluidas de los ensayos clínicos. Las formas de depósito de agonistas de la hormona liberadora de gonadotropina (GnRH) están aprobadas para la terapia preoperatoria a corto plazo para los miomas, causan amenorrea en casi el 90% de las pacientes y reducen el volumen uterino entre un 30 y un 60%; Sin embargo, se acompañan de una alta incidencia de síntomas hipogonadales, incluyendo pérdida ósea y sofocos.16. También causan un “brote esteroide” en la mayoría de las pacientes, que ocurre cuando se liberan las gonadotropinas almacenadas y causan sangrado menstrual abundante posterior cuando los niveles de estrógeno disminuyen rápidamente.
Terapias médicas para los fibromas y los síntomas relacionados con los fibromas.
La introducción de combinaciones de antagonistas de GnRH orales para el cuidado de los fibromas ha sido un avance importante en el tratamiento. Los agentes que han sido aprobados en los Estados Unidos combinan en una tableta o cápsula un antagonista de GnRH oral (elagolix o relugolix), que inhibe rápidamente la esteroidogénesis ovárica (sin causar un brote), con estradiol y progestina en dosis que resultan en niveles sistémicos que son equivalentes a los de la fase folicular temprana. Un agente que ha sido aprobado en la Unión Europea (linzagolix) está disponible en dos dosis: una dosis que suprime parcialmente la función hipotalámica y otra que proporciona una supresión completa de la función hipotalámica, similar a la observada con las dosis aprobadas de elagolix y relugolix. Cada una de estas formulaciones está disponible con o sin estrógeno y progestina. La formulación de dosis baja de linzagolix sin esteroides gonadales añadidos (estrógeno y progestina) proporciona el mismo efecto que la combinación de dosis alta con hormona exógena en personas que prefieren no tomar esteroides gonadales exógenos[17-19]. El enfoque de la terapia combinada o la supresión parcial de la función hipotalámica proporciona un alivio sintomático que es equivalente a la monoterapia con un antagonista de GnRH de dosis completa, con un mejor perfil de efectos secundarios. La única ventaja de la monoterapia de dosis alta es que produce una mayor reducción del volumen uterino, similar a la observada con el tratamiento con agonistas de GnRH, aunque con más síntomas hipogonadales.19.
Los datos de los ensayos clínicos muestran que las combinaciones orales de antagonistas de GnRH reducen eficazmente el sangrado menstrual abundante (entre un 50 y un 75 %), el dolor (entre un 40 y un 50 %) y los síntomas relacionados con la masa con una modesta reducción del volumen (disminución del volumen uterino, aproximadamente un 10 %), con bajos niveles de efectos secundarios (con sofocos, dolores de cabeza y náuseas que se producen en <20 % de las participantes). La eficacia de la terapia de combinación oral con antagonistas de GnRH es independiente de la extensión de la enfermedad fibroide (tamaño, número o ubicación de los fibromas), la presencia de adenomiosis concomitante u otros factores que limitan las terapias quirúrgicas.[18]. Las combinaciones orales de antagonistas de GnRH están aprobadas actualmente en los Estados Unidos para 24 meses de uso y en la Unión Europea para una duración ilimitada del tratamiento. Sin embargo, no se ha demostrado que estos medicamentos proporcionen anticonceptivos, lo que constituye una limitación para su uso a largo plazo en muchas personas. Se está realizando un ensayo clínico para probar la eficacia anticonceptiva de la terapia combinada con relugolix (número de ClinicalTrials.gov, NCT04756037).
En muchos países, los moduladores selectivos del receptor de progesterona son una opción para el tratamiento médico[22]. Sin embargo, las preocupaciones sobre los efectos tóxicos hepáticos raros pero graves han limitado su aceptación y disponibilidad. Ningún modulador selectivo del receptor de progesterona ha sido aprobado en los Estados Unidos para el tratamiento de los fibromas.22.
ALTERNATIVAS QUIRÚRGICAS E INTERVENCIONISTAS A LA HISTERECTOMÍA
Se han desarrollado numerosos procedimientos para reducir el sangrado y el tamaño de los fibromas y mejorar la calidad de vida sin histerectomía. La información sobre el tamaño y la ubicación de los fibromas es importante para determinar si se necesita un abordaje transcervical o abdominal. En general, los fibromas más pequeños que se clasifican como tipos 1 a 4 (que se encuentran en los espacios submucosos a intramurales) se pueden tratar por vía transcervical . Los fibromas más grandes de cualquier tipo, o los fibromas más pequeños que son subserosos (tipos 5, 6 y 7), se tratan por vía abdominal .
Abordajes transcervicales para las terapias de fibromas que preservan el útero.
Abordajes abdominales para las terapias de fibromas que preservan el útero.
El procedimiento con mayor evidencia de eficacia es la embolización de la arteria uterina, que utiliza un cateterismo intervencionista mínimamente invasivo, guiado radiológicamente, para liberar partículas embólicas directamente en ambas arterias uterinas; este proceso causa un infarto isquémico de los miomas y posteriores disminuciones en el sangrado, el dolor y los síntomas relacionados con la masa[23,24]. La embolización de la arteria uterina está ampliamente disponible. Aunque un ensayo aleatorizado mostró que la miomectomía era superior a la embolización de la arteria uterina con respecto a la mejora en la calidad de vida, ambos enfoques proporcionaron un alivio sustancial de los síntomas, aunque no se utilizó un tratamiento simulado como comparador en el ensayo .24.
Resultados de ensayos controlados aleatorizados de terapias para los miomas.
Los procedimientos que reducen el tamaño de los miomas individuales con el uso de energía para crear necrosis coagulativa incluyen la ablación por ultrasonido focalizado (con el uso de guía por resonancia magnética o ultrasonido) y la ablación por radiofrecuencia (con el uso de guía por ultrasonido laparoscópico o transcervical). Estas intervenciones reducen el sangrado menstrual abundante y los síntomas relacionados con la masa. Sin embargo, a diferencia de la embolización de la arteria uterina, en la que se pueden tratar todos los miomas al mismo tiempo, estas terapias requieren la focalización individual de cada mioma y no están tan fácilmente disponibles. La ablación por radiofrecuencia de los miomas se puede realizar al mismo tiempo que otras terapias quirúrgicas, como la escisión laparoscópica de la endometriosis o la miomectomía histeroscópica de un mioma tipo 0. Los datos de ensayos controlados aleatorizados que comparan todos los procedimientos mínimamente invasivos son limitados .
La miomectomía, o la extirpación quirúrgica de los miomas, sigue siendo una opción para muchas personas, aunque se utiliza con más frecuencia en personas que buscan activamente el embarazo o en aquellas con miomas muy grandes en quienes la reducción sería inadecuada. La mayoría de las pautas sugieren la extirpación quirúrgica de los miomas, en lugar de procedimientos que los reduzcan, para optimizar la fertilidad, debido a la larga experiencia con la miomectomía. Sin embargo, la miomectomía a menudo obliga a las pacientes a una futura cesárea, lo que en sí mismo aumenta la morbilidad relacionada con el embarazo.
RECURRENCIA DE LOS FIBROMAS
Una de las principales limitaciones de todas las terapias quirúrgicas e intervencionistas es que la incidencia de recurrencia de los fibromas es alta, y se desarrollan nuevos fibromas aproximadamente en el 50% de las personas dentro de los 5 años posteriores a la miomectomía. Sin embargo, no todos los fibromas nuevos se vuelven sintomáticos, lo que es especialmente cierto en las personas que están más cerca de la menopausia. Los porcentajes de pacientes que se someten a una nueva intervención varían según el procedimiento, la edad de la paciente, la extensión de los fibromas y los síntomas, y generalmente alcanzan el 33% en un período de hasta 5 años después del tratamiento, con porcentajes más bajos entre las personas mayores de 45 años que entre las de 45 años o menos[23,41]. No se han realizado estudios de seguimiento a más largo plazo.
Aunque las pacientes pueden someterse a múltiples intervenciones secuenciales para preservar el útero, la histerectomía es el modo de terapia más común. Un estudio reciente en una población con seguro comercial mostró que casi el 60% de las pacientes que se sometieron a una histerectomía por fibromas no habían recibido un tratamiento conservador previamente.42.
HISTERECTOMÍA
Aunque tradicionalmente se ha considerado que la histerectomía es la cura de los miomas, los nuevos datos sobre los resultados tras el uso de alternativas adecuadas muestran que estas pueden tener una eficacia similar a la de la histerectomía en lo que respecta al control del sangrado abundante. Las desventajas de la histerectomía, en comparación con las alternativas, incluyen el riesgo perioperatorio y la ooforectomía (si se incluye como parte del procedimiento). La extirpación de ambos ovarios en el momento de la histerectomía fue un procedimiento común hasta principios de la década de 2000, cuando grandes estudios de cohorte mostraron riesgos elevados de muerte, enfermedad cardiovascular, demencia y otras enfermedades en comparación con la histerectomía más conservación de ovarios[43,44]. Desde entonces, las tasas de ooforectomía han disminuido, mientras que las tasas de histerectomía no lo han hecho.45.
Varios estudios han demostrado riesgos sustancialmente mayores de enfermedad cardiovascular, ansiedad, depresión y muerte después de la histerectomía, incluso con la conservación de ambos ovarios [46-48]. Los riesgos son mayores entre las pacientes que tienen 35 años de edad o menos en el momento de la histerectomía. Entre estas pacientes, los riesgos de enfermedad de la arteria coronaria (con ajuste por factores de confusión) fueron 2,5 veces más altos y los riesgos de insuficiencia cardíaca congestiva fueron 4,6 veces más altos, durante un seguimiento medio de 22 años, entre las que se habían sometido a histerectomía como entre las mujeres sin histerectomía. La mortalidad fue de 8 a 29% más alta entre las pacientes que se habían sometido a una histerectomía con conservación de ovario antes de los 40 años de edad que entre las mujeres sin histerectomía[49,50]. Sin embargo, las pacientes que se someten a una histerectomía tienen más afecciones coexistentes, como obesidad, hiperlipidemia o antecedentes de cirugía, que las mujeres sin histerectomía, y debido a la naturaleza observacional de estos estudios, no se puede confirmar la causalidad.46. Aunque los estudios controlan estos riesgos inherentes, aún pueden estar presentes factores de confusión no medidos. Las personas que están contemplando la histerectomía merecen asesoramiento sobre estos riesgos, ya que muchas personas con fibromas pueden aprovechar alternativas menos invasivas a la histerectomía.
Actualmente no hay estrategias disponibles para la prevención primaria o secundaria de los fibromas. Los estudios epidemiológicos han identificado varios factores asociados con un riesgo reducido de fibromas, incluidos los siguientes: dietas ricas en frutas y verduras con carne roja limitada, ejercicio regular, control de peso, niveles normales de vitamina D[51], nacimiento vivo exitoso (paridad), uso de anticonceptivos orales y formulaciones de depósito de progesterona. Se necesitan ensayos controlados aleatorizados para determinar si la modificación de estos factores reducirá los riesgos. Por último, los estudios sugieren que el estrés y el etnicismo pueden desempeñar un papel en las disparidades de salud con respecto al desarrollo de los fibromas.52.
Áreas de incertidumbre
Existen muchas necesidades insatisfechas en el campo de la medicina de los fibromas, incluido un modelo de predicción de riesgos; un sistema de estadificación; ensayos clínicos aleatorizados de gran escala y eficacia comparativa; y métodos de prevención primaria y secundaria. Además, dado que tradicionalmente se ha considerado que el cuidado de los fibromas se limita al departamento de ginecología, la detección temprana y el tratamiento médico en entornos de atención primaria podrían minimizar potencialmente la morbilidad y la incidencia de histerectomías innecesarias, y se justifican ensayos de detección basados en la atención primaria.
Las áreas de estudio futuras deben incluir la detección de personas jóvenes (en particular, de personas jóvenes de etnia negra) que tienen síntomas de fibromas o una fuerte historia familiar de fibromas para determinar si la terapia temprana reduciría los riesgos a largo plazo . Un estudio de detección por ultrasonidos en el que participaron 1600 participantes de etnia negra de entre 23 y 35 años de edad mostró una prevalencia basal de fibromas del 23 %[53]. El inicio temprano de esteroides anticonceptivos o combinaciones de antagonistas de GnRH orales en personas afectadas con fibromas sintomáticos puede reducir el riesgo de cirugía o la extensión de la cirugía.
Algoritmo para el manejo de los fibromas uterinos sintomáticos.
Un estudio reciente que muestra el tratamiento insuficiente de las personas de etnia negra con fibromas con opciones de conservación del útero al comienzo de su recorrido de fibromas enfatiza los déficits en el abordaje de las disparidades en materia de salud.54. Comprender y eliminar las barreras mediante la investigación en ciencias sociales y del comportamiento sería un paso importante para reducir las disparidades en materia de salud en el cuidado de los fibromas.
Guías
El Colegio Estadounidense de Obstetras y Ginecólogos y la Sociedad de Obstetras y Ginecólogos de Canadá han publicado guías de práctica y opiniones de comités para el tratamiento de los miomas uterinos[20,22]. Ambas organizaciones respaldan la individualización de la atención para la paciente y tienen en cuenta el deseo de preservar la fertilidad o el útero, aumentar la calidad de vida y reducir los síntomas. Ambas organizaciones también recomiendan el tratamiento médico como tratamiento de primera línea para los miomas sintomáticos[20,22]. Cuando se indican enfoques intervencionistas, estas organizaciones también recomiendan enfoques mínimamente invasivos para tratar los miomas sintomáticos, incluidos los enfoques mínimamente invasivos para la histerectomía. Nuestras recomendaciones concuerdan con estas guías.
Conclusiones y recomendaciones
Con respecto a la paciente presentada en el caso clínico, recomendaríamos que la paciente comience una terapia combinada oral con antagonistas de GnRH, con suplementos de hierro y multivitamínicos, y también recomendaríamos una reevaluación anual o un seguimiento más temprano si se desea el embarazo o si los síntomas se intensifican. La intervención quirúrgica o de procedimiento también podría aliviar los síntomas, pero estas opciones tienen un mayor riesgo de complicaciones. Dado que la paciente priorizó la fertilidad, la histerectomía sería apropiada solo si tuviera cáncer comprobado mediante biopsia. Para una paciente que ha completado la maternidad, aunque la histerectomía permite la eliminación definitiva de los fibromas y el cese del sangrado menstrual, los riesgos a largo plazo asociados con la histerectomía (incluso con la conservación de los ovarios) deben analizarse durante el asesoramiento y la toma de decisiones compartida. Se prefiere la identificación y el tratamiento médico de los fibromas en etapas más tempranas de la enfermedad y en entornos de atención primaria.
Referencias Bibliográficas
1.
Baird DD, Dunson DB, Hill MC, Cousins D, Schectman JM. High cumulative incidence of uterine leiomyoma in black and white women: ultrasound evidence. Am J Obstet Gynecol 2003;188:100-107.
2.
Peddada SD, Laughlin SK, Miner K, et al. Growth of uterine leiomyomata among premenopausal black and white women. Proc Natl Acad Sci U S A 2008;105:19887-19892.
Go to Citation
3.
Borah BJ, Nicholson WK, Bradley L, Stewart EA. The impact of uterine leiomyomas: a national survey of affected women. Am J Obstet Gynecol 2013;209(4):319.e1-319.e20.
4.
Ghant MS, Sengoba KS, Vogelzang R, Lawson AK, Marsh EE. An altered perception of normal: understanding causes for treatment delay in women with symptomatic uterine fibroids. J Womens Health (Larchmt) 2016;25:846-852.
5.
Cardozo ER, Clark AD, Banks NK, Henne MB, Stegmann BJ, Segars JH. The estimated annual cost of uterine leiomyomata in the United States. Am J Obstet Gynecol 2012;206(3):211.e1-211.e9.
Go to Citation
6.
Ghant MS, Sengoba KS, Recht H, Cameron KA, Lawson AK, Marsh EE. Beyond the physical: a qualitative assessment of the burden of symptomatic uterine fibroids on women’s emotional and psychosocial health. J Psychosom Res 2015;78:499-503.
Go to Citation
7.
Marsh EE, Ekpo GE, Cardozo ER, Brocks M, Dune T, Cohen LS. Racial differences in fibroid prevalence and ultrasound findings in asymptomatic young women (18-30 years old): a pilot study. Fertil Steril2013;99:1951-1957.
Go to Citation
8.
Wechter ME, Stewart EA, Myers ER, Kho RM, Wu JM. Leiomyoma-related hospitalization and surgery: prevalence and predicted growth based on population trends. Am J Obstet Gynecol 2011;205(5):492.e1-5.
Go to Citation
9.
Wegienka G, Stewart EA, Nicholson WK, et al. Black women are more likely than white women to schedule a uterine-sparing treatment for leiomyomas. J Womens Health (Larchmt) 2021;30:355-366.
Go to Citation
10.
Orellana M, Riggan KA, DSouza K, et al. Perceptions of ethnoracial factors in the management and treatment of uterine fibroids. J Racial Ethn Health Disparities 2022;9:1184-1191.
Go to Citation
11.
Hartmann KE, Fonnesbeck C, Surawicz T, et al. Management of uterine fibroids. Rockville, MD: Agency for Healthcare Research and Quality, December 2017 (https://effectivehealthcare.ahrq.gov/products/uterine-fibroids/research-2017).
Go to Citation
12.
Siedhoff MT, Wheeler SB, Rutstein SE, et al. Laparoscopic hysterectomy with morcellation vs abdominal hysterectomy for presumed fibroid tumors in premenopausal women: a decision analysis. Am J Obstet Gynecol 2015;212(5):591.e1-591.e8.
Go to Citation
13.
Hindman N, Kang S, Fournier L, et al. MRI evaluation of uterine masses for risk of leiomyosarcoma: a consensus statement. Radiology 2023;306(2):e211658-e211658.
14.
Dueholm M, Lundorf E, Hansen ES, Ledertoug S, Olesen F. Accuracy of magnetic resonance imaging and transvaginal ultrasonography in the diagnosis, mapping, and measurement of uterine myomas. Am J Obstet Gynecol 2002;186:409-415.
Go to Citation
15.
Munro MG, Critchley HO, Broder MS, Fraser IS, FIGO Working Group on Menstrual Disorders. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet 2011;113:3-13.
Go to Citation
16.
Donnez J, Tomaszewski J, Vázquez F, et al. Ulipristal acetate versus leuprolide acetate for uterine fibroids. N Engl J Med 2012;366:421-432.
17.
Schlaff WD, Ackerman RT, Al-Hendy A, et al. Elagolix for heavy menstrual bleeding in women with uterine fibroids. N Engl J Med 2020;382:328-340.
18.
Al-Hendy A, Lukes AS, Poindexter AN III, et al. Treatment of uterine fibroid symptoms with relugolix combination therapy. N Engl J Med 2021;384:630-642.
19.
Donnez J, Taylor HS, Stewart EA, et al. Linzagolix with and without hormonal add-back therapy for the treatment of symptomatic uterine fibroids: two randomised, placebo-controlled, phase 3 trials. Lancet2022;400:896-907.
20.