Aunque la infección por SARS-CoV-2 en niños es leve o asintomática, en algunos niños se asocia con el desarrollo de una afección inflamatoria grave post-infecciosa llamada síndrome inflamatorio multisistémico en niños (MIS-C) . MIS-C es caracterizada por desregulación inmunológica y tormenta de citocinas, y la enfermedad tiene características superpuestas de miocarditis, síndrome de choque tóxico y enfermedad de Kawasaki (KD), una vasculitis infantil febril aguda . Si bien existe una morbilidad aguda considerable con MIS-C (casi dos tercios de los pacientes necesitan tratamiento de cuidados intensivos), la mortalidad es baja (1,9%) y los resultados a corto plazo son favorables. Debido a la novedad del síndrome y su similitud con KD , la mayoría de los centros han extrapolado las guías de KD para el manejo clínico de MIS-C.
Nuestra comprensión de los mecanismos moleculares que desencadenan MIS-C aún está evolucionando; sin embargo, recientes estudios han demostrado una participación muy importante de la Interleucina 1(IL-1) en el desarrollo de la respuesta hiperinflamatoria. Para comprender la patogenia de MIS-C y la fuente de IL-1β, Zhu y colaboradores comparó la expresión de IL-1β en varias células inmunes de pacientes con MIS-C, pacientes con KD y controles niños febriles. La citometría de flujo intracelular usando anticuerpos monoclonales específicos para IL-1β humana indicó que los leucocitos IL-1β+ eran altamente predominantes en los pacientes con KD, seguido de los pacientes con MIS-C. Un análisis adicional del patrón de las células inmunes identificó a los neutrófilos como una fuente principal de IL-1β. Los estudios de mRNA en neutrófilos de pacientes con MIS-C confirmó la elevada expresión de IL-1β pero no de IL-1α. Cabe señalar que el porcentaje aumentado de neutrófilos IL-1β+ no fué específico para KD o MIS-C y también se observó en los pacientes controles con cuadros febriles comunes. Por lo tanto, parece que la sobre representación y activación de los neutrófilos IL-1β+ es una característica común de las afecciones inflamatorias pediátricas.
Zhu y colaboradores utilizaron citometría de flujo para analizar más a fondo el fenotipo de los neutrófilos en distintos grados de desarrollo y observaron que los neutrófilos de MIS-C y KD muestran patrones de expresión distintos de marcadores de adhesión y activación. Si bien los neutrófilos de ambos grupos de pacientes tenían niveles similares de CD44, CD54, CD63, HLA-DR y el receptor Fcγ de alta afinidad CD64; la expresión de CD62L, CD66b, CD11b y los receptores Fcγ de baja afinidad CD16 y CD32 fue más alta en MIS-C.
Por otro lado, los marcadores de maduración, incluidos CD49d, CD101 y CD10, fueron más prominentes en el grupo de control febril, lo que indica la presencia de un número mayor de neutrófilos inmaduros en los pacientes con KD y MIS-C. Syrimi y colaboradores, también reportaron hallazgos similares, documentaron la presencia de una mayoría de neutrófilos con expresión disminuida de marcadores de maduración en pacientes con MIS-C.
Las señales que desencadenan la activación de neutrófilos en MIS-C aún no están claras. MIS-C se desarrolla de 3 a 6 semanas después de la exposición al SARS-CoV-2. Se ha reportado que estos pacientes mantienen una respuesta hiper-inflamatoria con IgG anti-SARS-CoV-2 muy elevada que podría desencadenar la activación de los neutrófilos. Acorde con esto, Zhu y colaboradores, describieron que la expresión tanto de CD32 como de CD16(receptores Fc para IgG) era más alta en los neutrófilos de pacientes con MIS-C en comparación con la observada en los neutrófilos de pacientes con KD. Además, varias de las citocinas inflamatorias que se mostraron elevadas en pacientes con MIS-C también podrían inducir la activación de los neutrófilos.
=> Recibir por Whatsapp las noticias destacadas
Los neutrófilos desempeñan un papel importante en la patogenia de KD y se han encontrado en las lesiones tempranas de las arterias coronarias características de la enfermedad. La evidencia actual también muestra que los neutrófilos juegan un papel importante en el desarrollo de MIS-C. Los datos de Zhu y colaboradores resumidos aquí proporcionan evidencia clara de la participación de los neutrófilos en las respuestas inflamatorias en MIS-C.
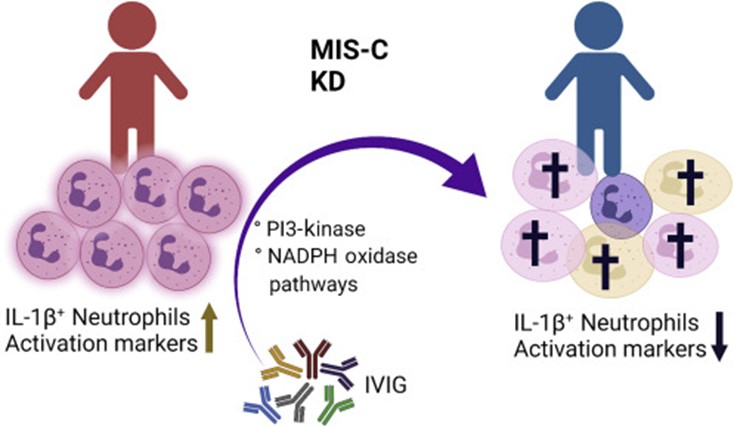
La inmunoglobulina intravenosa (IVIG), un pool de IgG de personas normales , se ha utilizado ampliamente como inmunoterapia para una variedad de afecciones autoinmunes e inflamatorias, incluida KD. Más recientemente, el American College of Rheumatology (ACR) publicó pautas que recomiendan la IVIG como primera terápia de línea en pacientes MIS-C. Después del tratamiento con IVIG, Zhu y colaboradores observaron una reducción de más del 50% en el recuento de neutrófilos y una reducción de más del 90% en los neutrófilos que expresan IL-1β en los grupos de pacientes con KD y con MIS-C. Este efecto notable fué evidente incluso en los pacientes que recibieron IGIV como única medicación inmunomoduladora .
Además, se encontró una disminución marcada en la activación y en la expresión de los marcadores de adhesión de los neutrófilos, lo que indica que la IVIG suprime a los neutrófilos IL-1β+ y de este modo, disminuye la inflamación en estas afecciones inflamatorias (Figura 1). Así pues, al demostrar el papel crítico de IL-1β en la patogenia de KD y MIS-C, este estudio agrega evidencia para el uso de anakinra, un antagonista del receptor de IL-1, en pacientes refractarios a la terápia con IVIG y/o corticoesteroides o como tratamiento inicial de estas enfermedades inflamatorias.
La muerte de los neutrófilos es crucial para la resolución de la inflamación mediada por estas células. Los autores intentaron identificar los mecanismos de muerte de neutrófilos inducida por IVIG utilizando inhibidores químicos in vitro e imágenes de células vivas. Encontraron que la muerte celular de neutrófilos inducida por IVIG fué bloqueada por inhibidores de fosfatidilinositol 3-quinasa (PI3K) y NADPH oxidasa, pero no con inhibidores de pan-caspasa, lo que indica que la muerte de neutrófilos inducida por IVIG no ocurre por apoptosis, piroptosis dependiente de caspasa-1, necroptosis y ferroptosis ( todos mecanismos de muerte celular). Este informe identifica que la IVIG y sub fragmentos F (ab ‘) 2 ejercen efectos citotóxicos sobre los neutrófilos de pacientes con trastornos inflamatorios a través de las vías dependientes de PI3K y NADPH oxidasa.
Previamente, se han reportado experimentos in vitro usando granulocitos aislados de donantes sanos que demuestran que la IGIV induce la muerte de los neutrófilos a través de vías dependientes e independientes de caspasa, mediadas por anticuerpos contra Fas y Siglec-9, respectivamente. La IGIV indujo muerte de neutrófilos independiente de caspasa a través de la vía de NADPH oxidasa. Tanto los pacientes con KD como con MIS-C muestran niveles disminuidos de varias citocinas proinflamatorias, que explican los efectos citotóxicos observados independientes de caspasa, que ejerció la IGIV sobre los neutrófilos. Hay que destacar que la morfología de los neutrófilos que sufrieron muerte celular independiente de caspasa, se asemeja a la de la muerte autofagolisosómica. Recientemente, se ha encontrado que la IVIG induce autofágia en las células mononucleares de sangre periférica por vías dependientes de F (ab ‘) 2- y PI3K. Dado que la muerte de células de neutrófilos inducida por IVIG en pacientes con KD y MIS-C también dependía de PI3K; las investigaciones futuras deberán centrarse en determinar si el mecanismo de la muerte de neutrófilos inducida por IVIG es por autofágia.
¿Este informe explica todos los posibles mecanismos de IVIG en MIS-C? Como lo señalaron correctamente los autores, el informe proporciona uno de los múltiples mecanismos de IVIG que podrían ser responsables de la mejora de la inflamación y la patología en MIS-C. La evidencia actual muestra que varios marcadores de inflamación están disminuidos en pacientes con MIS-C después de la terapia con IVIG. De hecho, se ha demostrado que la IVIG suprime la activación de linfocitos T, monocitos, células dendríticas y células endoteliales que se activan en MIS-C . Además, se observó una activación polyclonal inespecífica de linfocitos B con producción de autoanticuerpos en MIS-C, y la IVIG puede también controlar dicha activación de los linfocitos B. La eficacia terapéutica de IVIG en los pacientes con MIS-C no es el resultado de anticuerpos contra SARSCov-2 , ya que las preparaciones de IVIG antes de la pandemia de COVID-19 no tienen anticuerpos anti-SARS-CoV-2.
No es todavía completo nuestro conocimiento sobre el panorama general de los mecanismos moleculares que conducen a MIS-C en algunos niños expuestos al SARS-CoV-2. El trabajo de Zhu y colaboradores demuestra que los neutrófilos y la IL-1β son actores importantes en la génesis de MIS-C. Un ensayo clínico aleatorizado en MIS-C sería útil para validar los hallazgos, pero ante la incertidumbre sobre la pandemia de COVID-19, podría ser difícil reclutar suficientes pacientes en un solo centro y podría ser necesaria la colaboración internacional. Se necesitan más estudios para identificar otros posibles mecanismos que ejerce la IVIG para suprimir la inflamación en MIS-C y asi poder usar las dosis acorde a las condiciones clínicas que se están tratando y utilizar de manera efectiva terápias complementarias, como corticoesteroides y otros inmunomoduladores biológicos en pacientes con MIS-C.
Figura 1. IVIG se dirige a los neutrófilos IL-1β+ para ejercer efectos antiinflamatorios en MIS-C y la enfermedad de Kawasaki (KD)
Ronald Palacios Castrillo