Es emocionante saber que se ha logrado desarrollar un puente digital entre el cerebro y la médula espinal para restaurar la comunicación interrumpida por una lesión en la médula espinal. Este avance, conocido como interfaz cerebro-columna vertebral (BSI, por sus siglas en inglés), utiliza sistemas de estimulación y registro completamente implantados para establecer un vínculo directo entre las señales cerebrales y la estimulación eléctrica epidural en la médula espinal.
La calibración de este BSI altamente confiable se realiza en pocos minutos, lo que facilita su uso tanto en entornos clínicos como en el hogar. Los resultados obtenidos hasta ahora han sido prometedores, con el participante con tetraplejia crónica informando que el BSI le ha permitido realizar movimientos de manera natural, como ponerse de pie, caminar, subir escaleras y moverse en terrenos complejos.
Además, se ha observado que la neurorehabilitación apoyada por el BSI ha mejorado la recuperación neurológica en el participante. Incluso cuando el BSI se encuentra apagado, el participante ha logrado recuperar la capacidad de caminar con muletas sobre el suelo, lo que indica que esta tecnología está ayudando en la restauración del control natural del movimiento después de la parálisis.
Este avance representa un hito significativo en el campo de la medicina y la neurociencia, ya que ofrece nuevas posibilidades para mejorar la calidad de vida de las personas con lesiones en la médula espinal. Aunque aún se necesitan más investigaciones y pruebas para su implementación generalizada, este puente digital entre el cerebro y la médula espinal abre la puerta a futuras terapias y tratamientos para ayudar a las personas con parálisis a recuperar su movilidad y autonomía.
TEXTO
=> Recibir por Whatsapp las noticias destacadas
Lorach, H., Galvez, A., Spagnolo, V. et al. Walking naturally after spinal cord injury using a brain–spine interface. Nature (2023). https://doi.org/10.1038/s41586-023-06094-5
Para caminar, el cerebro envía órdenes ejecutivas a las neuronas ubicadas en la médula espinal lumbosacra. Aunque la mayoría de las lesiones de la médula espinal no dañan directamente estas neuronas, la interrupción de las vías descendentes interrumpe los comandos derivados del cerebro que son necesarios para que estas neuronas produzcan la marcha. La consecuencia es la parálisis permanente.
Anteriormente demostramos que la estimulación eléctrica epidural dirigida a las zonas de entrada de la raíz dorsal individual de la médula espinal lumbosacra permite la modulación de grupos motores específicos de las piernas. A su vez, el reclutamiento de estas zonas de entrada de la raíz dorsal con secuencias espaciotemporales preprogramadas replica la activación fisiológica de los conjuntos motores de las piernas que subyacen a la bipedestación y la marcha. Estas secuencias de estimulación restauraron la bipedestación y la marcha básica en personas con parálisis debido a una lesión de la médula espinal. Sin embargo, esta recuperación requería sensores de movimiento portátiles para detectar intenciones motoras a partir de movimientos residuales o estrategias compensatorias para iniciar las secuencias de estimulación preprogramadas. En consecuencia, el control de la marcha no se percibía como completamente natural. Además, los participantes mostraron una capacidad limitada para adaptar los movimientos de las piernas al terreno cambiante y las demandas volitivas.
Aquí, demostramos que un puente digital entre el cerebro y la médula espinal permitiría el control voluntario sobre el tiempo y la amplitud de la actividad muscular, restaurando un control más natural y adaptativo de estar de pie y caminar en personas con parálisis por lesión de la médula espinal.
Puente digital del cerebro a la médula espinal
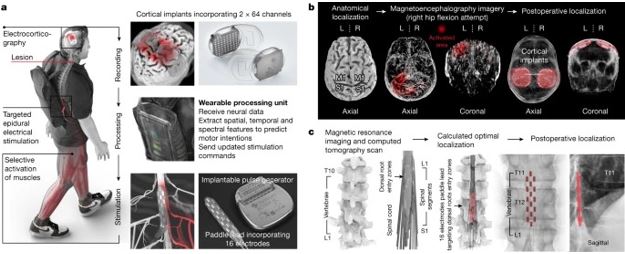
Para establecer este puente digital, integramos dos sistemas completamente implantados que permiten el registro de la actividad cortical y la estimulación de la médula espinal lumbosacra de forma inalámbrica y en tiempo real (Fig. 1a).
Fig. 1: Diseño, tecnología e implantación del BSI.
a, Dos implantes corticales compuestos por 64 electrodos se colocan de manera epidural sobre la corteza sensoriomotora para recolectar señales ECoG. Una unidad de procesamiento predice las intenciones motoras y traduce estas predicciones en la modulación de programas de estimulación eléctrica epidural dirigidos a las zonas de entrada de la raíz dorsal de la médula espinal lumbosacra. Los estímulos se administran mediante un generador de impulsos implantable conectado a un cable de paleta de 16 electrodos. b, Imágenes que informan la planificación preoperatoria de las ubicaciones de los implantes corticales y la confirmación posoperatoria. L, izquierda; R, correcto. c, Modelo computacional personalizado que predice la ubicación óptima del cable de paleta para apuntar a las zonas de entrada de la raíz dorsal asociadas con los músculos de las extremidades inferiores y confirmación posoperatoria.
Para monitorear las señales electrocorticográficas (ECoG) de la corteza sensoriomotora, aprovechamos la tecnología WIMAGINE. Los implantes WIMAGINE consisten en una rejilla de 8 x 8 de 64 electrodos (paso de 4 mm × 4,5 mm en los ejes anteroposterior y mediolateral, respectivamente) y componentes electrónicos de registro que están incrustados dentro de una caja de titanio de forma circular de 50 mm de diámetro que tiene el mismo espesor como el cráneo. La geometría del sistema favorece un contacto estrecho y estable entre los electrodos y la duramadre, y hace que los dispositivos sean invisibles una vez implantados en el cráneo.
Dos antenas externas están integradas en un auricular personalizado que garantiza un acoplamiento fiable con los implantes. La primera antena alimenta la electrónica implantada a través del acoplamiento inductivo (alta frecuencia, 13,56 MHz), mientras que la segunda antena de ultra alta frecuencia (UHF, 402–405 MHz) transfiere señales ECoG en tiempo real a una estación base portátil y una unidad de procesamiento, que genera predicciones en línea de intenciones motoras sobre la base de estas señales ( Fig. 1).
Las intenciones motoras decodificadas se convierten luego en comandos de estimulación que se transfieren a un software personalizado que se ejecuta en la misma unidad de procesamiento.
Estos comandos se envían al generador de pulsos implantable ACTIVA RC (Fig. 1a), que se usa comúnmente para brindar estimulación cerebral profunda en pacientes con enfermedad de Parkinson. Actualizamos este implante con módulos de comunicación inalámbrica que permitieron el ajuste en tiempo real sobre la ubicación y el momento de la estimulación eléctrica epidural con una latencia de aproximadamente 100 ms ( Fig. 1).
A continuación, se envían corrientes eléctricas a las zonas de entrada de la raíz dorsal objetivo mediante el cable de paleta implantable Specific 5-6-5, que consta de una matriz que incorpora 16 electrodos.
Esta cadena integrada de hardware y software estableció un puente digital inalámbrico entre el cerebro y la médula espinal: una interfaz cerebro-columna vertebral (BSI) que convierte la actividad cortical en la modulación analógica de los programas de estimulación eléctrica epidural para sintonizar la activación de los músculos de las extremidades inferiores y, por lo tanto, recuperar la posición de pie y caminar después de la parálisis debido a una lesión de la médula espinal .
Implantación neuroquirúrgica del BSI
En el contexto del ensayo clínico Stimulation Movement Overground (STIMO)-BSI (clinicaltrials.gov, NCT04632290), inscribimos a un hombre de 38 años que había sufrido una lesión cervical incompleta (C5/C6) de la médula espinal durante un accidente de bicicleta diez años antes. Anteriormente había participado en el ensayo clínico STIMO (clinicaltrials.gov, NCT02936453), que involucró un programa de neurorehabilitación de cinco meses respaldado por estimulación eléctrica epidural específica de la médula espinal. Este programa le permitió recuperar la capacidad de caminar con la ayuda de un andador de rueda delantera. A pesar del uso continuo de la estimulación en el hogar, durante aproximadamente tres años, había alcanzado una meseta de recuperación neurológica, lo que lo motivó a inscribirse en STIMO-BSI.
Para guiar la implantación del BSI, desarrollamos procedimientos de planificación preoperatoria que nos permitieron optimizar el posicionamiento de los implantes de registro y estimulación sobre el cerebro y la médula espinal.
El BSI requiere la detección de características neurales relacionadas con la intención de mover las extremidades inferiores derecha e izquierda. Para identificar las regiones corticales más sensibles al intento de mover cada articulación de los miembros inferiores, adquirimos datos de imagen anatómicos y funcionales basados en tomografía computarizada y magnetoencefalografía (Fig. 1b). Estas adquisiciones identificaron las regiones de la corteza cerebral que respondían con más fuerza a la intención de mover las extremidades inferiores izquierda y derecha. Integramos esta información con restricciones anatómicas para definir el posicionamiento óptimo de los dos implantes de registro ECoG que tienen como objetivo decodificar los movimientos de las extremidades inferiores derecha e izquierda. La ubicación de ambos implantes se subió a un sistema de neuronavegación para establecer la planificación preoperatoria de la intervención neuroquirúrgica.
Bajo anestesia general, se realizó una incisión bicoronal del cuero cabelludo para permitir dos craneotomías de forma circular sobre las ubicaciones planificadas de los hemisferios izquierdo y derecho, utilizando un trépano circular hecho a medida que coincidía con el diámetro de los implantes. Luego reemplazamos los colgajos óseos con los dos dispositivos de registro implantables, antes de cerrar el cuero cabelludo.
El cable de la paleta se colocó sobre las zonas de entrada de la raíz dorsal de la médula espinal lumbar durante el ensayo clínico STIMO. La posición óptima del cable se identificó utilizando un modelo personalizado de la columna elaborado a partir de imágenes estructurales de alta resolución (Fig. 1c). La ubicación final se optimizó intraoperatoriamente sobre la base de registros electrofisiológicos. El generador de impulsos implantable, que estaba conectado al cable, se insertó en un bolsillo subcutáneo abdominal.El participante fué dado de alta 24 h después de cada intervención neuroquirúrgica.
Montaje de implantes corticales y espinales
La calibración del BSI requirió dos procedimientos independientes para seleccionar las características de las grabaciones de ECoG que discriminan la intención de moverse y configurar programas de estimulación que modulan conjuntos específicos de músculos de las extremidades inferiores.
El primer procedimiento consistió en extraer las características espaciales, espectrales y temporales de las señales de ECoG que estaban vinculadas a la intención de movilizar cada articulación de ambos miembros inferiores. Para este propósito, se le pidió al participante que intentara movimientos de cadera, rodilla y tobillo de los lados izquierdo y derecho en una posición sentada, durante los cuales se registraron simultáneamente las señales de ECoG. Este mapeo permitió la identificación de los electrodos, las características espectrales y las ventanas temporales que capturaron la mayor cantidad de información relacionada con el movimiento . Los electrodos que midieron las señales neurales que se correlacionaban con los movimientos de las piernas se ubicaron en la parte más medial del implante, rostral al surco central, como se esperaba sobre la base de los registros magnetoencefalográficos preoperatorios. La distribución espacial de estos electrodos siguió una somatotopía que permitió la discriminación precisa de los movimientos de la cadera, la rodilla y el tobillo . Por otro lado, los movimientos relacionados con el miembro superior coincidieron con la modulación de las señales ECoG medidas a través de electrodos ubicados en la cara lateral del implante . La información relacionada con el movimiento estaba contenida en todo el rango de bandas de frecuencia beta y gamma de las señales ECoG . Este procedimiento nos permitió configurar los implantes con características óptimas para permitir que el participante opere el BSI .
El segundo procedimiento consistió en configurar los programas de estimulación . La estimulación eléctrica epidural de la médula espinal puede modular conjuntos específicos de grupos motores a través del reclutamiento de las zonas de entrada de la raíz dorsal que se proyectan hacia las regiones de la médula espinal donde residen estos grupos motores. A su vez, las configuraciones optimizadas de ánodos y cátodos pueden dirigir los campos eléctricos hacia subconjuntos específicos de zonas de entrada de la raíz dorsal para modular conjuntos bien definidos de conjuntos de neuronas motoras. Este principio fisiológico permite la regulación de los movimientos de extensión y flexión de cada articulación. Aprovechamos este principio para configurar una biblioteca de programas de estimulación eléctrica epidural específicos que movilizaron las articulaciones de la cadera, la rodilla y el tobillo de ambos lados. Concretamente, configuramos combinaciones de ánodos y cátodos, frecuencias de estimulación y amplitudes para dirigir las corrientes eléctricas para lograr un control gradual sobre la actividad de los grupos musculares objetivo .
Calibración online adaptativa del BSI
Luego aprovechamos las configuraciones de los implantes corticales y espinales para calibrar el BSI sobre la base de un algoritmo multilineal de conmutación Aksenova/Markov ponderado exponencialmente recursivo que vinculó las señales ECoG con el control de los parámetros de estimulación eléctrica epidural (Fig. 1).
El algoritmo fue diseñado para generar dos predicciones separadas. Primero, un modelo de puerta calculó la probabilidad de la intención de mover una articulación específica. En segundo lugar, un modelo multilineal independiente predijo la amplitud y la dirección del movimiento previsto. Las propiedades adaptativas del algoritmo permitieron la parametrización incremental en línea de los modelos a lo largo del período de calibración. Un modelo oculto de Markov aseguró la estabilidad y robustez de las predicciones.
Luego traducimos las predicciones del algoritmo en un controlador analógico que ajustaba la amplitud de los comandos de estimulación específicos de las articulaciones. Estos comandos actualizados se enviaron al generador de impulsos implantable cada 300 ms.
Ya en la primera sesión después de la intervención neuroquirúrgica, el algoritmo calibró un BSI que permitió al participante controlar la flexión relativa de las caderas izquierda y derecha de un avatar proyectado en una pantalla . Luego integramos el control analógico sobre la amplitud de estimulación al algoritmo. Desde una posición acostada, en menos de dos minutos, el participante pudo controlar la actividad de los músculos de la cadera para generar un torque con una precisión del 97% .
Luego ampliamos este marco BSI para permitir que el participante controle la amplitud relativa de las articulaciones de la cadera, la rodilla y el tobillo bilateralmente junto con el estado de reposo, lo que suma un total de siete estados. Usando este BSI proporcional que combina siete estados, el participante logró un control gradual sobre el movimiento de cada articulación bilateralmente con una precisión del 74 ± 7%, mientras que el nivel de probabilidad se limitó al 14% . La latencia del decodificador fué tan baja como 1,1 s (±0,15 s sem) para los siete estados.
Estas primeras sesiones validaron el procedimiento para la calibración rápida, robusta y precisa de un BSI que opera en múltiples dimensiones.
Recuperación inmediata de la marcha natural
Luego preguntamos si este procedimiento es compatible con la calibración de un BSI que restablece el control natural de la marcha.
Caminar involucra secuencias bien definidas de patrones de activación muscular que apoyan la aceptación del peso, la propulsión y el balanceo de las extremidades inferiores derecha e izquierda. Estas secuencias coinciden con la activación de piscinas motoras ubicadas dentro de regiones bien segregadas de la médula espinal lumbosacra. Por lo tanto, seleccionamos los programas de estimulación dentro de la biblioteca que apuntaban a los músculos asociados con las funciones de aceptación de peso, propulsión y oscilación, y vinculamos estos programas a las probabilidades de decodificación. Calibramos el BSI para permitir que el participante controle la amplitud relativa de los programas de estimulación para la aceptación del peso y las funciones de oscilación.
Primero probamos este BSI durante elevaciones voluntarias del pie mientras estaba de pie. Después de solo 5 minutos de calibración, el BSI apoyó el control continuo sobre la actividad de los músculos flexores de la cadera, lo que permitió al participante lograr un aumento de cinco veces en la actividad muscular en comparación con los intentos sin el BSI .
Proporcionamos la misma configuración para apoyar la marcha con muletas. El BSI permitió un control continuo, intuitivo y robusto de la marcha . Cuando se apagó el BSI, el participante perdió instantáneamente la capacidad de realizar cualquier paso, a pesar de los intentos detectados de caminar a partir de la modulación de la actividad cortical. Caminar se reanudó tan pronto como se volvió a encender el BSI. El participante pudo decidir si iniciar el paso, caminar continuamente, detenerse o permanecer de pie en silencio sin la detección de falsos positivos que afectarían el rendimiento de pie . De hecho, las evaluaciones de la escala de equilibrio de Berg revelaron que el BSI no afectó, e incluso mejoró ligeramente, las habilidades generales de equilibrio .
El participante informó que el BSI permitió un control natural sobre sus movimientos al caminar . Nuestro objetivo era capturar esta percepción subjetiva con resultados cuantificados. Para este propósito, aplicamos un análisis de componentes principales a la cinemática de todo el cuerpo y la actividad muscular recopilada durante la marcha en una cinta rodante con el BSI o con los mismos programas de estimulación controlados en un circuito cerrado sobre la base de sensores de movimiento conectados a los pies. En comparación con la estimulación sola, el BSI permitió caminar con características de marcha que estaban notablemente más cerca de las cuantificadas en individuos sanos . El BSI aseguró un vínculo continuo entre el movimiento previsto y la modulación de los protocolos de estimulación, lo que se tradujo en la capacidad de caminar sobre el suelo de forma independiente con muletas. Cuando los sensores de movimiento detectaron los movimientos previstos, el participante informó un desajuste temporal frecuente entre las detecciones y sus intenciones, lo que perjudicó su capacidad para caminar en estas condiciones .
Navegación sobre terreno complejo
A continuación, nos propusimos investigar si el BSI podría permitir un control intuitivo y natural sobre las actividades complejas de la vida diaria que no serían posibles sin el BSI.
Cuando el participante se inscribió en STIMO, siete años después de su accidente, no podía caminar de forma independiente. La finalización de este ensayo clínico le permitió recuperar la marcha básica cuando se encendió la estimulación, aunque esta recuperación requirió estrategias compensatorias para activar las secuencias de estimulación basadas en elevaciones del talón. También recuperó la movilidad parcial sin estimulación. Sin embargo, experimentó dificultades para pasar de estar de pie a caminar y detenerse, y solo podía caminar sobre superficies planas. Además, no pudo ajustar los movimientos de las extremidades inferiores para avanzar sobre rampas, superar obstáculos o subir escaleras, como es necesario para apoyar la movilidad en la vida cotidiana.
Para demostrar que el BSI solucionó estas limitaciones, diseñamos una sucesión de modelos que emulaban las condiciones subyacentes a estas actividades de la vida diaria.
Primero preguntamos si el participante podía caminar en un terreno empinado que requería una modulación adaptativa de la amplitud de la actividad muscular. Con el BSI, el participante subió y bajó una rampa empinada con facilidad, realizando esta tarea dos veces más rápido que sin estimulación. El BSI también permitió un alto espacio libre para los escalones, según fuera necesario para subir una sucesión de escaleras, sortear obstáculos y atravesar terrenos cambiantes . Todas estas tareas se realizaron con la misma configuración BSI, que demostró ser altamente confiable para admitir una amplia variedad de tareas con restricciones muy diferentes .
Estabilidad a largo plazo del BSI
Luego buscamos evaluar la estabilidad del BSI. Para ello, cuantificamos la estabilidad de las señales y decodificadores corticales a lo largo del tiempo, y la necesidad de ajustar los programas de estimulación.
Después de un período transitorio de un mes, durante el cual las señales corticales exhibieron cambios modestos en el contenido espectral de las diferentes bandas de frecuencia, las señales ECoG se mantuvieron estables durante los meses siguientes . La disminución de la potencia espectral se limitó a 0,03 dB por día en promedio. Esta estabilidad permitió un rendimiento sólido. Por ejemplo, encontramos que el mismo decodificador permitía al participante lograr un control gradual sobre seis articulaciones a pesar de un intervalo de dos meses entre ambas sesiones . Aprovechamos esta solidez durante la neurorehabilitación, ya que solo recalibramos el BSI cuando el participante o los fisioterapeutas lo consideraron necesario para promover el mejor rendimiento funcional posible. A pesar de estas recalibraciones, las características de los decodificadores se mantuvieron notablemente estables con el tiempo . De hecho, la calidad de la señal y la precisión de la decodificación al caminar se han mantenido globalmente sin cambios durante casi un año de uso . Mientras que las características corticales se mantuvieron estables a lo largo del tiempo, detectamos un refuerzo progresivo de su profundidad de modulación, lo que reveló mejoras graduales en la capacidad del participante para modular su actividad cortical cuando opera el BSI .
La biblioteca de programas de estimulación mostró la misma estabilidad. El rango óptimo de amplitudes de estimulación dependía de la configuración específica de los electrodos y los músculos objetivo . Sin embargo, estos rangos de amplitudes de estimulación se mantuvieron estables durante un año de uso y los umbrales de estimulación no cambiaron con el tiempo.
recuperación neurológica
El estudio clínico se diseñó para investigar si la neurorehabilitación respaldada por BSI mejora aún más la recuperación neurológica . Antes de inscribirse en STIMO-BSI, el participante había completado el ensayo clínico STIMO, que le permitió recuperar el control volitivo sobre los músculos previamente paralizados y mejorar sus funciones de bipedestación y marcha. Sin embargo, después de tres años de entrenamiento regular solo con estimulación, había alcanzado una meseta de recuperación .
El participante completó 40 sesiones de neurorehabilitación que involucró caminar con BSI, movimientos monoarticulares con BSI, equilibrio con BSI y fisioterapia estándar. Debido a que las deficiencias eran más pronunciadas en los músculos flexores de la cadera, enfocamos principalmente los ejercicios de entrenamiento y las configuraciones de BSI en el control de estos músculos.
Este programa de neurorehabilitación medió una mejora pronunciada en el control volitivo de los músculos flexores de la cadera y los movimientos de flexión de la cadera asociados sin estimulación . Esta recuperación se correlacionó con ganancias en las puntuaciones sensoriales (4 puntos en la puntuación sensorial del tacto ligero) y motoras , y capacidades mejoradas para pararse y caminar que se capturaron en un aumento en las puntuaciones WISCI II de 6 antes de STIMO a 16 después de STIMO- BSI . Concretamente, el participante exhibió mejoras en todas las evaluaciones clínicas convencionales, como la prueba de la marcha de seis minutos, las capacidades de carga, el tiempo de levantarse y andar, la escala de equilibrio de Berg y la calidad de la marcha evaluada mediante la escala de análisis de la marcha observacional por fisioterapeutas ciegos a la estudio . Estas mejoras sin estimulación se tradujeron en un aumento significativo en la calidad de vida, como caminar de forma independiente por la casa, entrar y salir de un automóvil o tomar una bebida con amigos parados en un bar .
Integración de la BSI en la vida diaria
El BSI mejoró las capacidades para pararse y caminar del participante, lo que nos obligó a desarrollar un marco BSI para uso independiente en el hogar.
Diseñamos un sistema que pudiera ser operado por el participante sin ninguna ayuda. Este sistema incluye un andador equipado con una caja integrada que incorpora todos los componentes del BSI . Una interfaz táctil permite al participante interactuar con el software personalizado para iniciar una actividad, verificar la colocación de los auriculares y ajustar las amplitudes mínima y máxima de los programas de estimulación. La configuración del hardware y el software se completa con entradas mínimas del usuario en menos de 5 min, después de lo cual el participante puede aprovechar el BSI para la neurorehabilitación o para apoyar las actividades de la vida diaria . El participante usó el sistema regularmente en el transcurso de 7 meses con un rendimiento de decodificación estable . Este uso doméstico se tradujo en un amplio aumento en los beneficios percibidos por el participante, según lo cuantificado por el cuestionario de la Escala de Impacto Psicosocial de Dispositivos de Asistencia (PIADS) . La seguridad, la habilidad y la capacidad de participar se clasificaron con las máximas ganancias posibles en este cuestionario.
Concebimos un puente digital inalámbrico entre el cerebro y la médula espinal que restauró el control natural sobre los movimientos de las extremidades inferiores para pararse y caminar en terrenos complejos después de la parálisis debido a una lesión de la médula espinal. Además, la neurorehabilitación medió mejoras neurológicas que persistieron incluso cuando se apagó el puente.
La validación de este puente digital se restringió a un solo individuo con daño severo pero parcial de la médula espinal y, por lo tanto, no está claro si el BSI será aplicable a otras ubicaciones y gravedades de lesiones. Sin embargo, varias observaciones sugieren que este enfoque será aplicable a una amplia población de personas con parálisis. En primer lugar, los principios fisiológicos subyacentes a la estimulación eléctrica epidural dirigida de la médula espinal ahora se han validado en nueve de cada nueve personas tratadas con lesiones incompletas y completas. En segundo lugar, desarrollamos procedimientos que respaldaron la calibración sencilla, rápida y estable del vínculo entre la actividad cortical y los programas de estimulación, lo que permitió al participante operar el BSI en casa sin supervisión. En tercer lugar, ahora se ha observado una robustez y estabilidad comparables de este marco de decodificación cerebral computacional y tecnológico en dos personas adicionales con tetraplejía. Si bien la experiencia previa del participante con la estimulación aceleró la configuración de la BSI, no prevemos mayores impedimentos para implementar una BSI en nuevos individuos. De hecho, pudimos configurar programas de estimulación que restauraron el paso en un día en tres participantes con parálisis sensoriomotora completa.
La administración de estimulación eléctrica epidural sobre la médula espinal lumbar ha permitido que muchas personas con lesión de la médula espinal recuperen el control adaptativo sobre la actividad de los músculos paralizados. Esta recuperación se ha documentado en varios estudios independientes, incluso en participantes con parálisis sensoriomotora completa. Estas observaciones indican que las vías del cerebro anatómicamente intactas, pero funcionalmente silenciosas, pueden modular el impacto de la estimulación eléctrica epidural en la actividad de la médula espinal debajo de la lesión. Sin embargo, estos estudios también reconocen una serie de limitaciones. En primer lugar, los parámetros de estimulación deben ajustarse con precisión sobre la base del músculo objetivo o la función motora deseada. En segundo lugar, el inicio de la estimulación debe sincronizarse con precisión con la intención motora. Tercero, el control finamente graduado sobre la actividad de los músculos requiere modular la amplitud de la estimulación. La BSI subsana estas tres limitaciones. En este escenario, las vías residuales y protésicas convergen en las mismas neuronas debajo de la lesión, lo que permite un control gradual y sostenido sobre la actividad de los músculos. Esta cooperación probablemente juega un papel esencial en la reorganización de las vías neuronales que median la recuperación neurológica en respuesta a la neurorehabilitación con el BSI. Se han informado observaciones comparables cuando las señales electroencefalográficas se acoplaron a un exoesqueleto o estimulación eléctrica funcional de los músculos durante la rehabilitación de la marcha en personas con lesión de la médula espinal. Sin embargo, la mala calidad de las señales electroencefalográficas en condiciones móviles, combinada con la impracticabilidad de este marco tecnológico, son un impedimento para la implementación clínica de estas estrategias no invasivas.
La neurorehabilitación apoyada por el puente digital medió mejoras neurológicas adicionales después de tres años de desempeño estable, a pesar del uso continuo de estimulación eléctrica epidural en el hogar. Estas mejoras se produjeron principalmente en el control de los músculos de la cadera, que era el objetivo principal de los programas de estimulación controlada por el cerebro durante la neurorehabilitación. Aunque se centró en un grupo de músculos, esta recuperación neurológica se tradujo en la capacidad de levantar la pierna contra la gravedad sin estimulación. Esta recuperación apoyó la marcha independiente con muletas.
En modelos preclínicos, la neurorehabilitación apoyada por un puente digital desencadenó una recuperación superior en comparación con la estimulación eléctrica epidural sola. La estimulación neuromuscular controlada por el cerebro también medió mejoras funcionales duraderas de los músculos comprometidos después de un accidente cerebrovascular y una lesión de la médula espinal. Como el participante había alcanzado previamente una meseta de recuperación después de una rehabilitación intensiva usando solo estimulación de la médula espinal, es razonable suponer que la BSI desencadenó una reorganización de las vías neuronales que fue responsable de la recuperación neurológica adicional. Estos resultados sugieren que el establecimiento de un vínculo continuo entre el cerebro y la médula espinal promueve la reorganización de las vías neuronales residuales que unen estas dos regiones en condiciones fisiológicas normales. Ampliar el concepto de un puente digital a la médula espinal cervical también puede restaurar los movimientos de brazos y manos después de una lesión de la médula espinal y un accidente cerebrovascular. Sin embargo, es importante apreciar que la cantidad relativa de recuperación neurológica necesariamente se correlacionará con la gravedad de la lesión.
Ampliar este puente digital requerirá varios desarrollos. En primer lugar, la utilización práctica del implante cortical requerirá la miniaturización de la estación base, la unidad informática y las antenas imperceptibles. La detección compresiva y el ajuste dinámico de los electrodos muestreados y las características podrían reducir aún más la huella del dispositivo cortical. En segundo lugar, el implante espinal debe estar dotado de capacidades de comunicación ultrarrápidas, parámetros de estimulación versátiles y control inalámbrico directo desde la unidad informática portátil. Finalmente, los implantes corticales y espinales podrían controlarse mediante un solo circuito integrado de baja potencia que incorpora un procesador neuromórfico con capacidad de autocalibración que traduce de forma autónoma la actividad cortical en actualizaciones de programas de estimulación. Si bien estos desarrollos requieren tiempo y recursos, no anticipamos obstáculos técnicos para realizar esta transición.
El concepto de un puente digital entre el cerebro y la médula espinal augura una nueva era en el tratamiento de los déficits motores por trastornos neurológicos.
Dos implantes corticales compuestos por 64 electrodos se colocan de manera epidural sobre la corteza sensoriomotora para recolectar señales ECoG. Una unidad de procesamiento predice las intenciones motoras y traduce estas predicciones en la modulación de programas de estimulación eléctrica epidural dirigidos a las zonas de entrada de la raíz dorsal de la médula espinal lumbosacra. Los estímulos se administran mediante un generador de impulsos implantable conectado a un cable de paleta de 16 electrodos. b, Imágenes que informan la planificación preoperatoria de las ubicaciones de los implantes corticales y la confirmación posoperatoria. L, izquierda; R, correcto. c, Modelo computacional personalizado que predice la ubicación óptima del cable de paleta para apuntar a las zonas de entrada de la raíz dorsal asociadas con los músculos de las extremidades inferiores y confirmación posoperatoria.
RESUMEN. RPC&ChatGPT
Ronald Palacios Castrillo, M.D., PhD.