Ronald Palacios Castrillo, M.D., PhD.
RESUMEN
La enfermedad de Graves y la tiroiditis de Hashimoto son dos problemas de salud relacionados con la glándula tiroides que pueden afectar a las personas. Aunque tienen síntomas diferentes, como producir demasiada o muy poca hormona tiroidea, en realidad tienen algo en común.
Imagínate que tu glándula tiroides es como una fábrica que produce hormonas importantes para el funcionamiento de tu cuerpo.
En la enfermedad de Graves, el sistema de defensa de tu cuerpo se vuelve loco y comienza a atacar a la glándula tiroides, haciendo que produzca demasiada hormona tiroidea. Esto puede hacer que te sientas muy activo, con el corazón acelerado y otros síntomas.
Por otro lado, en la tiroiditis de Hashimoto, el sistema de defensa también ataca la glándula tiroides, pero de una manera diferente. En este caso, la glándula tiroides se daña y no puede producir suficiente hormona tiroidea. Esto puede hacer que te sientas cansado, deprimido y con otros síntomas relacionados con la falta de energía.
Aunque estos dos problemas parecen ser opuestos, algunos científicos creen que tienen un origen similar. Piensa en el sistema de defensa de tu cuerpo como un ejército que protege tu organismo. A veces, este ejército encuentra células anormales en la glándula tiroides que podrían causar problemas a largo plazo. Para evitar que estas células anormales se conviertan en un problema mayor, el ejército las ataca.
Sin embargo, cuando el ejército ataca estas células anormales, también puede dañar las células sanas de la glándula tiroides. Esto desencadena una respuesta del sistema inmunológico que causa la enfermedad de Graves o la tiroiditis de Hashimoto, dependiendo de cómo reaccione el cuerpo.
El origen de las dos enfermedades autoinmunes de la tiroides (enfermedad de Graves y tiroiditis de Hashimoto) sigue sin comprenderse lo suficiente.
A pesar de sus manifestaciones clínicas opuestas de hipertiroidismo e hipotiroidismo, proponemos un origen compartido basado en un mecanismo fisiológico de vigilancia autoinmune contra las células mutantes hipersecretoras, lo que puede explicar los vínculos observados entre estas enfermedades.
La enfermedad de Graves (GD) y la tiroiditis de Hashimoto (HT) son enfermedades autoinmunes comunes de la glándula tiroides, que causan hipertiroidismo e hipotiroidismo, respectivamente. A pesar de su manifestación clínica opuesta, tienen varios vínculos enigmáticos. Aquí, proponen que GD y HT tienen el mismo origen fundamental: ambas enfermedades son el costo de un proceso fisiológico beneficioso llamado vigilancia autoinmune de mutantes hipersecretores.
Las células T autorreactivas eliminan selectivamente las células mutantes que hipersecretan las hormonas y amenazan con convertirse en nódulos tóxicos. Estas células T pueden desencadenar una respuesta humoral en individuos susceptibles, lo que lleva a la producción de anticuerpos contra los antígenos tiroideos y la destrucción de las çelulas tiroideas y por consiguiente, al hipotiroidismo.
Este origen compartido puede explicar las similitudes en la incidencia y los factores de riesgo entre la HTA y la GD, a pesar de sus fenotipos clínicos opuestos.
En resumen, la enfermedad de Graves y la tiroiditis de Hashimoto son problemas relacionados con la glándula tiroides que pueden causar síntomas diferentes. Aunque parecen ser opuestos, se piensa que ambos tienen un origen similar en el sistema de defensa del cuerpo que ataca células anormales en la glándula tiroides. Esto puede ayudar a explicar por qué estas dos enfermedades comparten algunos factores de riesgo y por qué algunas personas pueden pasar de una a otra.
La enfermedad de Graves y la tiroiditis de Hashimoto contrastan clínicamente pero comparten varias características GD y HT son trastornos autoinmunes de la glándula tiroides.
Afectan a ~5% de la población general en todo el mundo, lo que las convierte en las enfermedades autoinmunes específicas de órganos más comunes en humanos .
En la GD, el sistema inmunitario produce autoanticuerpos que estimulan el receptor de la hormona estimulante de la tiroides (TSHR). En consecuencia, la glándula tiroides produce un exceso de hormonas tiroideas, lo que provoca hipertiroidismo.
Por el contrario, la TH es una condición en la que las células T autorreactivas y los autoanticuerpos destruyen la tiroides, lo que lleva al hipotiroidismo. Los autoanticuerpos en la HT son específicos para los antígenos tiroideos tiroglobulina (Tg) y peroxidasa tiroidea (TPO).
A pesar de los efectos opuestos de GD y HT en la tiroides, varias observaciones enigmáticas vinculan las dos enfermedades (Figura 1). En primer lugar, los pacientes con GD o HT comparten el mismo factor de riesgo genético principal, la variante HLA-DR3 del antígeno leucocitario humano (HLA); específicamente, el alelo HLA-DRβ1-Arg74.
En segundo lugar, además de tener anticuerpos estimulantes de la tiroides (TSAb), entre el 60 y el 80 % de los pacientes con GD en todo el mundo también son positivos para los autoanticuerpos anti-TPO y anti-Tg , que son las características distintivas de HT. En tercer lugar, los pacientes con GD pueden desarrollar HTA y viceversa.
Estas características comunes entre las dos enfermedades no se conocen bien. Una teoría es que la infiltración linfocítica de la tiroides en la GD puede conducir a la propagación molecular de la respuesta de anticuerpos TSHR a otros autoantígenos tiroideos, lo que lleva a la HT , aunque esto aún debe probarse más a fondo.
Aquí, cuestionamos el origen de GD en términos de un proceso fisiológico hipotético que involucra células T específicas de TSHR autorreactivas en todos los individuos sanos. Este proceso previene la expansión de células tiroideas mutantes, que de otro modo causarían nódulos tiroideos tóxicos.
Sin embargo, este proceso esencial tiene un costo: en individuos con factores de riesgo genéticos, como HLA-DR3, puede conducir a la activación de células B y la producción de autoanticuerpos TSHR, causando GD. Esto proporciona una nueva explicación para el origen de GD, que aclara muchas de sus características compartidas con HT.
Para ahondar en esta explicación, recurrimos a una teoría reciente de enfermedades autoinmunes llamada vigilancia autoinmune de mutantes hipersecretores .
La teoría de la vigilancia autoinmune sugiere que las células T autorreactivas eliminan las células mutantes hipersecretoras
La teoría de la vigilancia autoinmune comienza con la observación de que los tipos de células secretoras propensas a enfermedades autoinmunes comparten un circuito regulador . En este circuito compartido, una señal induce tanto la secreción como la proliferación celular. La secreción conduce a un bucle de retroalimentación negativa que reduce la señal de inducción. A esto lo llamamos el «circuito de secretar y crecer» (Figura 2, arriba) .
El circuito de secreción y crecimiento aparece en la tiroides. La señal de entrada es TSH, una hormona pituitaria que induce a las células foliculares tiroideas a producir hormonas tiroideas T3 y T4 y a proliferar y crecer . A su vez, las hormonas tiroideas inhiben la producción de TSH , formando un ciclo de retroalimentación negativa que mantiene la concentración de hormona tiroidea en homeostasis.
Se ha demostrado que este circuito cumple varias funciones clave. Proporciona control de tamaño a la tiroides al vincular el crecimiento celular y la función celular en la misma señal . Bloquea la masa funcional de la tiroides en un tamaño que proporciona una función adecuada, es decir, concentraciones normales de hormona tiroidea.
Cuando las concentraciones de hormonas tiroideas son insuficientes, las concentraciones de TSH aumentan, induciendo una mayor producción y, en una escala de tiempo más lenta, aumentando la masa funcional tiroidea (fenómeno conocido como bocio), asegurando que las hormonas tiroideas alcancen la homeostasis . Por ejemplo, el bocio se produce cuando las concentraciones de yodo, necesarias para la síntesis de la hormona tiroidea, son bajas .
Sin embargo, el circuito de secretar y crecer tiene una fragilidad fundamental. Es sensible a las células mutantes que hipersensan la señal. Estas células pueden convertirse en un clon grande que hipersecreta la hormona (Figura 2, abajo a la izquierda).
Tales células tiroideas mutantes que hipersensan la TSH debido a mutaciones específicas en el TSHR crecen en un clon conocido como nódulo tiroideo tóxico , que causa hipertiroidismo.
Se puede hacer una estimación de la frecuencia de tales mutantes hipersensibles en función de la tasa de mutación conocida y el número de mutaciones diferentes de TSHR que dan lugar a nódulos tóxicos, ~ 50 en la tiroides humana . La tiroides debería tener cientos de estas células mutantes para cuando se desarrolle y, por lo tanto, cada individuo debería tener cientos de nódulos tóxicos.
Por lo tanto, la eliminación de estos mutantes parece ser esencial para mantener la homeostasis (Figura 2, centro inferior).
La teoría de la vigilancia autoinmune propuso una estrategia para eliminar tales mutantes. Esta teoría propone que las células T autorreactivas que detectan autoantígenos en la vía de secreción pueden destruir selectivamente las células mutantes que secretan en exceso la hormona.
Estas células secretoras expresan más autoantígenos en sus complejos principales de histocompatibilidad (MHC) de superficie; quizás también expresen fragmentos de proteínas defectuosas como antígeno debido a su fenotipo de sobreexpresión . Las células T reconocen estas células mutantes, ya sea en virtud del mayor número de autoantígenos presentados o de antígenos alterados, y eliminan las células.
Esto da una desventaja selectiva a las células mutantes y evita que los clones hipersecretores aumenten/progresen. Así, la teoría proporciona una función fisiológica a las células T que son autorreactivas con la tiroides y, de manera análoga, a las células T que son autorreactivas con otras células endocrinas reguladas por un circuito similar, como las células beta del páncreas. Estas células T autorreactivas se encuentran en todos los individuos sanos.
Las células T reactivas de la tiroides tienen receptores de células T (TCR) que pertenecen al repertorio público de TCR compartido por todos los humanos, e incluso se encuentran en la intersección del repertorio público compartido por humanos y ratones.
Esta evidencia sugiere que estas células T autorreactivas no son simplemente escapadas de la selección tímica y otros mecanismos de tolerancia, sino que son esenciales para mantener la homeostasis fisiológica.
La teoría de la vigilancia autoinmune también se relaciona con la identidad de los autoantígenos en cada enfermedad. Ayuda a explicar por qué muchos de los autoantígenos más comunes en las enfermedades autoinmunes endocrinas se originan a partir de proteínas en las vías de secreción hormonal. Dichos antígenos son ideales para propósitos de vigilancia porque se expresan más fuertemente en mutantes hipersecretores que en células de tipo salvaje.
De hecho, en la HTA, la producción de Tg y TPO es el último paso de la síntesis de hormonas tiroideas, y sus anticuerpos se utilizan como marcador clínico de la enfermedad. De manera similar, la pre-proinsulina y otros antígenos en la diabetes mellitus tipo 1, la 21-hidroxilasa en la enfermedad de Addison autoinmune y otros autoantígenos se ajustan a esta predicción .
Sin embargo, esta estrategia antimutante fisiológica tiene un costo: las células T autorreactivas pueden mediar enfermedades autoinmunes en individuos susceptibles al desencadenar una respuesta humoral (Figura 2, abajo a la derecha).
Lo más probable es que esta activación ocurra en individuos que expresan alelos HLA específicos conocidos, junto con factores ambientales, como infecciones.
Los anticuerpos participan en el daño tisular al atacar las células para su destrucción, lo que provoca la liberación de más autoantígenos, lo que propaga aún más el ataque autoinmune en un círculo vicioso que puede conducir a una enfermedad autoinmune en toda regla.
Vigilancia autoinmune como origen común de GD e HTA
Extendemos la teoría de la vigilancia autoinmune para incluir GD, con el objetivo de explicar el origen de los autoanticuerpos contra TSHR. Por lo tanto, planteamos la hipótesis de que, además de Tg y TPO, la vigilancia autoinmune de la tiroides utiliza TSHR como un autoantígeno adicional para detectar células mutantes hipersecretoras.
Esto se debe a que se supone que las células mutantes que sobreexpresan TSHR producen más hormona tiroidea y proliferan, amenazando con convertirse en nódulos tóxicos.
Por lo tanto, se predice que los individuos sanos albergarán células T contra los antígenos TSHR para eliminar estas células mutantes. En individuos susceptibles (p. ej., portadores de HLA-DR3), estas células T pueden desencadenar que las células B produzcan anticuerpos anti-TSHR y algunos de estos son anticuerpos estimulantes que dan lugar a la GD [31].
Esta teoría para la GD proporciona una etiología compartida con la HTA: ambas enfermedades son el costo de un mecanismo fisiológico contra las células tiroideas mutantes hipersensibles. La HTA es el resultado de la vigilancia autoinmune contra los antígenos Tg o TPO, mientras que la GD es el resultado de la vigilancia autoinmune contra los antígenos TSHR (Figura 3, Figura clave).
Esta etiología compartida predice que muchas personas deberían albergar células T contra los antígenos GD y HT, y esto podría explicar por qué el 70% de los pacientes con GD tienen anticuerpos anti-Tg y anti-TPO junto con anticuerpos anti-TSHR.
El origen compartido de la enfermedad de Graves y la tiroiditis de Hashimoto predice una incidencia similar relacionada con la edad y el sexo
Si GD y HT comparten el mismo origen fundamental, uno podría predecir que tendrán perfiles de incidencia dependientes de edad y sexo similares.
Para explorar esto y con fines ilustrativos, se analizaron datos de Claliti, una organización de servicios de salud israelí de aproximadamente la mitad de la población israelí mayor de 18 años (2002-2020), que cubre ~50 millones de años de vida. Utilizaron los códigos de la Clasificación Internacional de Enfermedades (CIE)-9 para calcular la incidencia dependiente de la edad de diferentes trastornos de la tiroides en hombres y mujeres. Los datos incluyeron N = 9560 casos GD y N = 27 015 casos HT.
La incidencia normalizada de GD y HT aumentó aproximadamente linealmente con la edad, alcanzando un máximo a los 60 años en los hombres y a los 50 años en las mujeres, y luego disminuyó (Figura 4, líneas azul y naranja). Ambas enfermedades fueron más prevalentes en mujeres que en hombres, con una tasa de incidencia similar de 1 a 4-6.
Por el contrario, otros trastornos tiroideos no autoinmunes aumentaron exponencialmente con la edad y alcanzaron su punto máximo 20 a 30 años después (Figura 4, líneas grises), incluido el cáncer de tiroides (N = 8911), nódulos tiroideos tóxicos (N = 7836), nódulos no tóxicos (N =103 721), y tirotoxicosis sin bocio (N = 9647).
El aumento lineal de las enfermedades autoinmunes de la tiroides también difería de la mayoría de las otras enfermedades no autoinmunes relacionadas con la edad, que aumentan exponencialmente con la edad.
Por lo tanto, GD y HT tienen perfiles de incidencia específicos de edad y sexo similares, lo que respalda la hipótesis del origen compartido.
Observaciones finales
Presentamos una hipótesis para un origen compartido de GD y HT, a pesar de su manifestación clínica opuesta. Se sugiere que ambas enfermedades son el costo de un mecanismo de vigilancia autoinmune beneficioso impulsado por células T autorreactivas contra células mutantes hipersecretoras en la glándula tiroides. Sin embargo, esta hipótesis de vigilancia autoinmune para enfermedades autoinmunes aún debe probarse.
Una prueba ideal sería explorar si, en tejidos endocrinos sanos, las células T autorreactivas naturales matan preferentemente a las células hipersecretoras y, por lo tanto, cumplen una función de vigilancia mutante . Observamos que los experimentos en ratones pueden no ser adecuados, porque sus tiroides pequeñas tienen el potencial de generar muy pocas células mutantes para justificar la selección evolutiva de un mecanismo de vigilancia autoinmune; es más probable que los humanos y otros mamíferos grandes requieran alguna forma de eliminar tales mutantes para prevenir la aparición de nódulos tóxicos.
Posteriormente, sería interesante explorar si la vigilancia autoinmune podría aplicarse a otras afecciones y trastornos autoinmunes mediados por autoanticuerpos.
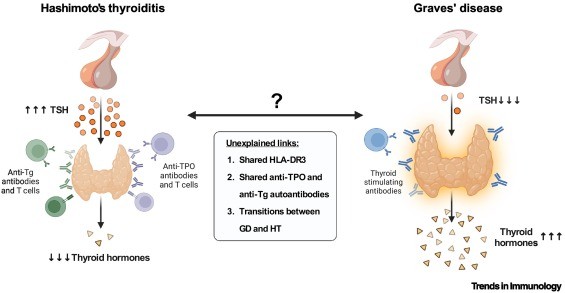
Figura 1.Varios vínculos inexplicables entre la enfermedad de Graves (GD) y su enfermedad opuesta, la tiroiditis de Hashimoto.
(HT).
En la HT, las células T y los autoanticuerpos destruyen la glándula tiroides, provocando hipotiroidismo. En la GD, los autoanticuerpos estimulan el receptor de la hormona estimulante de la tiroides (TSHR), lo que provoca agrandamiento de la tiroides e hipertiroidismo.
A pesar de sus efectos opuestos, estas enfermedades tienen tres vínculos enigmáticos: (1) los pacientes con GD y HT comparten HLA-DR3 ; (2) 60-80% de los pacientes con GD también son positivos para autoanticuerpos HT [anti-peroxidasa tiroidea (TPO) y anti-tiroglobulina (Tg)] ; y
(3) GD puede transformarse en HT y viceversa . Abreviatura: HLA, antígeno leucocitario humano.
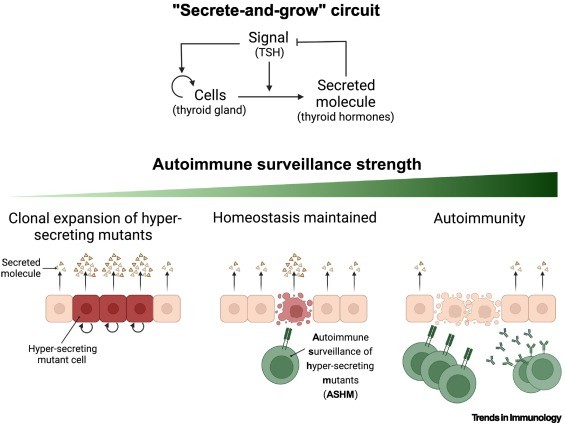
Figure 2.Teoría de la vigilancia autoinmune.
Esta teoría sugiere un papel fisiológico para las células T autorreactivas en individuos sanos, eliminando las células mutantes que hipersensan una señal que aumenta tanto la secreción de hormonas como la proliferación de células tiroideas. Muchos sistemas endocrinos comparten un circuito regulador común, donde una señal de entrada induce a las células endocrinas a secretar sus hormonas y crecer; llamamos a este motivo ‘el circuito de secretar y crecer’ (panel superior) .
La regulación de la tiroides es un ejemplo de tal circuito. La hormona estimulante de la tiroides (TSH) funciona como una señal de entrada que hace que las células foliculares de la tiroides secreten las hormonas tiroideas T3 y T4 y crezcan . Las hormonas tiroideas suprimen la producción de TSH en la glándula pituitaria para formar un circuito de retroalimentación negativa.
El circuito de secreción y crecimiento es susceptible a los mutantes hipersecretores (panel inferior izquierdo) porque tienen una proliferación excesiva y pueden convertirse en un nódulo tóxico.
Se supone que las células T autorreactivas eliminan estos mutantes en función de su mayor presentación de autoantígenos para mantener la homeostasis (panel central inferior). Sin embargo, la vigilancia excesiva puede conducir a enfermedades autoinmunes en individuos susceptibles (panel inferior derecho).
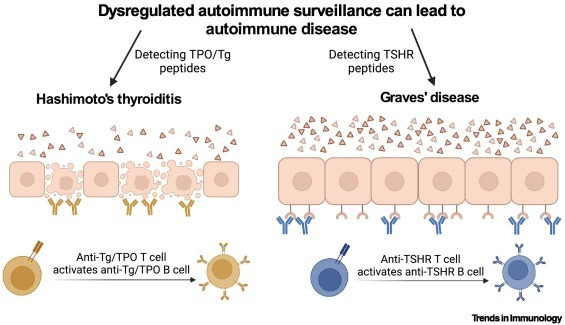
Figura 3. Modelo de vigilancia autoinmune desregulada como origen compartido de la enfermedad de Graves (GD) y la tiroiditis de Hashimoto (HT).
La sobreexpresión de tiroglobulina (Tg), peroxidasa tiroidea (TPO) o receptor de la hormona estimulante de la tiroides (TSHR) puede indicar que una célula tiroidea es un mutante hipersecretor. Para evitar que genere un nódulo tóxico, las células T autorreactivas detectan péptidos derivados de proteínas sobreexpresadas.
En individuos susceptibles, un evento estocástico (como una infección) puede activar las células B correspondientes y puede sobrevenir una enfermedad autoinmune en toda regla. La identidad del objetivo de las células T dicta el tipo de enfermedad: Tg/TPO para HT y TSHR para GD.