Ronald Palacios Castrillo
Resumen
Los ancestros humanos modernos se separaron de los ancestros de los neandertales y los denisovanos hace unos 600.000 años.
Hasta hace unos 40.000 años, estos tres grupos existieron en paralelo, ocasionalmente se encontraron e intercambiaron genes. Una pregunta crítica es por qué los humanos modernos, y no los otros dos grupos, sobrevivieron, se hicieron numerosos y desarrollaron culturas complejas.
Ceberg, et.al., ( CELL. February 16, 2024.DOI:https://doi.org/10.1016/j.cell.2023.12.029, )discuten las diferencias genéticas entre los grupos y algunas de sus consecuencias funcionales.
=> Recibir por Whatsapp las noticias destacadas
A medida que se disponga de más secuencias genómicas actuales de diversos grupos, predicen que muy pocas diferencias, si es que hay alguna, distinguirán a todos los humanos modernos de todos los neandertales y denisovanos.
Ceberg y colegas proponen que la base genética de lo que constituye a un ser humano moderno se considera mejor como una combinación de características genéticas, donde quizás ninguna de ellas esté presente en todos y cada uno de los individuos actuales.
Introducción
Un grupo de humanos se separó de los antepasados de los humanos modernos hace unos 600.000 años en África. Los miembros de ese grupo finalmente abandonaron África y se convirtieron en neandertales en el oeste de Eurasia y en denisovanos en el este de Eurasia, respectivamente. Más tarde, los humanos modernos, es decir, los antepasados de todos los pueblos actuales, surgieron en África y se extendieron por ese continente y más allá, encontrándose con neandertales y denisovanos, así como con otras formas humanas que probablemente existieron en esa época fuera de África.
Como resultado, los neandertales y los denisovanos, así como otras formas de los llamados humanos arcaicos que existieron en ese momento, desaparecieron del registro arqueológico hace unos 40.000 años (Figura 1).
Los humanos modernos desarrollaron una cultura y una tecnología que cambiaron rápidamente y les permitieron volverse muy numerosos y colonizar todas las partes habitables del mundo. Un misterio central es por qué los humanos modernos se han vuelto tan numerosos y culturalmente diversos, mientras que los neandertales y los denisovanos desaparecieron.
Aunque los neandertales, los denisovanos y los humanos modernos comparten un ancestro común, sólo mantuvieron un contacto limitado entre sí.
Eso significa que la evolución humana se ha producido esencialmente tres veces en el último medio millón de años. Se puede reconstruir aspectos de las historias evolutivas de estos grupos y los contactos limitados entre ellos utilizando secuencias genómicas.
Para los humanos modernos, tenemos cientos de miles de genomas actuales y datos de todo el genoma de miles de humanos que vivieron durante los últimos 45.000 años. Para los neandertales, tenemos tres secuencias genómicas de buena calidad y una docena o ya sea de calidad moderada o baja, lo que nos permite identificar variantes genéticas que probablemente hayan sido portadas por la mayoría o incluso por todos los individuos entre ellos.
Actualmente, sólo está disponible un genoma denisovano de buena calidad. Aunque habrá más genomas arcaicos disponibles, el conocimiento de la variación genética arcaica siempre será más limitado que el conocimiento de la gente actual.
Las comparaciones de genomas de las tres formas de humanos muestran que intercambiaron genes varias veces cuando se encontraron fuera de África (Figura 1). Los neandertales recibieron flujo de genes de grupos relacionados con los ancestros de los humanos modernos hace más de 100.000 años.
Además, los neandertales y los denisovanos intercambiaron genes; por ejemplo, hace unos 80.000 a 90.000 años en el sur de Siberia, se identificó a un individuo que tenía una madre neandertal y un padre denisovano. Cuando los humanos modernos comenzaron a extenderse fuera de África y el Cercano Oriente hace menos de 100.000 años, se mezclaron con los neandertales y los denisovanos.
Como resultado, todas las personas que tienen raíces genéticas fuera de África al sur del Sahara portan variantes genéticas que provienen de los neandertales.
Los antepasados de las personas en Asia también se mezclaron con los denisovanos y, por lo tanto, las personas de ascendencia asiática portan variantes denisovanas además de las variantes neandertales. Esta contribución genética de los denisovanos es particularmente grande en algunas poblaciones de Oceanía.
El campo ahora va más allá de la descripción de la mezcla entre los grupos y comienza a explorar los impactos funcionales de las variantes genéticas que difieren entre ellos. Ceberg y colegas discutieron lo que podemos aprender del estudio de variantes genéticas de origen neandertal y denisovano en la gente actual, con énfasis en las variantes fisiológicamente relevantes.
Se centraron en ejemplos en los que variantes genéticas únicas se han relacionado con ciertos rasgos. Otros aspectos han sido revisados en otra parte.
Considerando que muchas variantes ancestrales o variantes que aparecieron en los neandertales o denisovanos se encuentran con frecuencias bajas o moderadas en algunas poblaciones hoy en día, también discuten cómo podríamos pensar sobre las bases genéticas y biológicas de lo que diferencia a los humanos modernos de los neandertales, los denisovanos y otras formas de humanos ahora extintos.
Variantes arcaicas
Cuando los humanos modernos y arcaicos se mezclaron, su descendencia de primera generación portaba un conjunto de cromosomas humanos modernos y un conjunto de cromosomas arcaicos. Cuando esos niños vivieron en poblaciones humanas modernas y a su vez tuvieron hijos, los cromosomas neandertales o denisovanos se rompieron y reorganizaron en cada generación debido al proceso de recombinación.
Como resultado, a lo largo de las aproximadamente 2000 generaciones que han transcurrido desde que los humanos modernos y arcaicos se encontraron, los segmentos de DNA arcaicos se hicieron más cortos y hoy se encuentran dispersos dentro de los genomas de las personas actuales.
La longitud esperada de un segmento de DNA arcaico se puede estimar como 1/(r × N), donde r es la tasa de recombinación y N el número de generaciones. Bajo los supuestos simplificadores de una tasa de recombinación promedio (~1 centimorgan por megapares de bases) y un solo evento de mezcla que ocurrió hace 2000 generaciones, la longitud típica esperada para un segmento de DNA arcaico hoy es de aproximadamente 50 kilobases (kb).
Sin embargo, para cada región genómica donde se encuentran segmentos de DNA arcaicos, se presentan como una distribución de fragmentos de diferentes longitudes, donde los extremos reflejan eventos de recombinación pasados . Sin embargo, para estar seguro de que un fragmento llegó mediante el flujo genético hace unas 2.000 generaciones, deben tener una longitud considerable.
También hay segmentos de DNA en el genoma humano que son similares a los genomas de Neandertal o Denisovan, no porque estos segmentos hayan sido aportados por los humanos arcaicos a los modernos, sino porque estos segmentos persistieron de forma independiente tanto en los humanos arcaicos como en los modernos, ya que las dos poblaciones compartían un ancestro común, hace aproximadamente medio millón de años.
Dado que la recombinación ha actuado durante mucho más tiempo en tales fragmentos, la probabilidad de que tengan más de 12 kb es inferior a 0,05 bajo la tasa de recombinación supuesta anteriormente, una longitud de rama neandertal de 19.500 generaciones y una longitud de rama humana moderna de 21.500 generaciones.
Esto da una idea aproximada de las diferencias de tamaño esperadas entre los fragmentos de DNA heredados de ancestros comunes (es poco probable que superen los 12 kb en promedio) y los heredados de neandertales o denisovanos más recientemente (se espera que sean de unos 50 kb).
Sin embargo, al examinar cualquier segmento en particular, es importante considerar que el tamaño depende de la tasa de recombinación local en la parte del genoma donde se encuentra un segmento de DNA arcaico. Esta tasa varía no sólo a lo largo del genoma sino también entre poblaciones y a lo largo del tiempo.
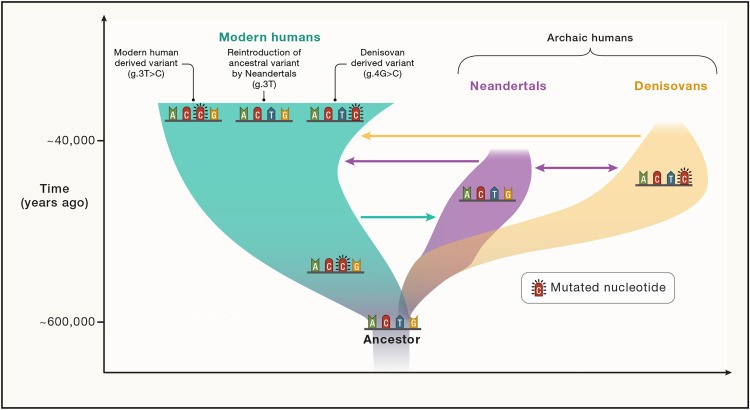
Suponiendo una tasa de mutación de 1,61 × 10−8 por sitio por generación y una longitud de rama neandertal de 19.500 generaciones, un segmento de DNA heredado de los neandertales con la longitud típica de 50 kb portará aproximadamente 16 variantes que resultan de mutaciones que ocurrieron en los neandertales, es decir, se “derivan” de los neandertales (Figura 1).
Además, los humanos modernos han acumulado casi la misma cantidad de cambios derivados independientemente de los neandertales.
Finalmente, dado que los neandertales y los humanos modernos a menudo heredaron diferentes versiones de segmentos de DNA que presentaban diferencias entre sí en la población ancestral, el número de diferencias entre los segmentos de DNA de los humanos modernos y los neandertales puede ser aún mayor. Por lo tanto, los segmentos de DNA arcaicos a menudo se destacan en el genoma humano porque portan más variantes de un solo nucleótido (SNV) que las regiones circundantes.
Flujo de genes arcaicos
Aunque las variantes neandertales se encuentran en todas las poblaciones fuera de África y constituyen aproximadamente el 2% de los genomas no africanos actuales, diferentes individuos de una población a menudo portan diferentes variantes neandertales y las frecuencias de las variantes individuales a veces pueden diferir drásticamente entre las poblaciones.
Un número menor de variantes derivadas de los neandertales también se encuentra en África al sur del Sahara como resultado del flujo de genes a África desde Europa y Asia occidental después de la desaparición de los neandertales.
El hecho de que la fracción de DNA neandertal en los genomas actuales sea relativamente consistente en alrededor del 2% sugiere que la mayor parte de las contribuciones neandertales ocurrieron relativamente temprano, tal vez hace unos 60.000 años, en poblaciones que abandonaron África y se convirtieron en ancestrales de todos los no humanos Africanos.
Sin embargo, los análisis de genomas humanos modernos derivados de especímenes de más de 40.000 años en Europa han demostrado que los neandertales también contribuyeron localmente a los grupos humanos modernos.
Por ejemplo, un individuo rumano de aproximadamente 40.000 años tenía un ancestro neandertal de 4 a 6 generaciones atrás en su árbol genealógico, y tres individuos de 45.000 años encontrados en un sitio en Bulgaria también tenían parientes neandertales cercanos.
Sin embargo, muchas de estas primeras poblaciones modernas no dejaron muchos o incluso ningún descendiente que contribuyera con variantes genéticas a las poblaciones actuales. Por lo tanto, esas contribuciones posteriores de los neandertales pueden haber tenido un impacto menor en las poblaciones actuales.
Las variantes provenientes de los denisovanos que se encuentran en las poblaciones de nativos americanos y de Asia continental contribuyen a aproximadamente el 0,2% de los genomas actuales.
En muchas poblaciones de Oceanía, más del 5% de los genomas son de origen denisovano. Las contribuciones genéticas denisovanas provienen de al menos dos poblaciones denisovanas distintas.
Uno de ellos estaba bastante relacionado con el genoma denisovano secuenciado en el sur de Siberia, y sus rastros se pueden encontrar en personas actuales en Japón, China y otras partes del este de Asia. La otra población denisovana contribuyó a los ancestros de poblaciones en gran parte de Asia, incluido el este y el sur de Asia.
Esta población denisovana estaba relacionada mucho más lejanamente con el genoma denisovano actualmente disponible.
Es posible que también hayan ocurrido contribuciones de otras poblaciones denisovanas a los antepasados de los pueblos del Pacífico. Una pregunta fascinante es cómo los cambios genéticos que se acumularon en los linajes humanos arcaicos y modernos afectaron la fisiología de las tres formas de humanos, dos de ellas que se extinguió.
Estudiar los efectos de las variantes arcaicas y modernas.
La presencia de variantes genéticas (típicamente SNV, pero también inserciones y eliminaciones y otros cambios en las secuencias de DNA) aportadas por los neandertales y los denisovanos a los humanos actuales nos permite investigar los efectos de dichas variantes preguntándonos si están asociadas con fenotipos actuales.
Estas variantes pueden resultar de mutaciones que ocurrieron en el linaje neandertal o denisovano; es decir, se derivan de esos linajes o, más raramente, de cambios ocurridos en el linaje común que condujo a los dos grupos arcaicos.
En particular, los segmentos de DNA arcaicos también pueden introducir variantes ancestrales en posiciones donde los humanos actuales portan variantes derivadas causadas por mutaciones que ocurrieron en los humanos modernos (Figura 1).
Las variantes que ocurrieron en el linaje humano moderno y están presentes en casi todos los individuos hoy en día no pueden estudiarse asociándolas con fenotipos, ya que casi nadie carece de estas variantes y, por lo tanto, no existe un grupo de control.
De manera similar, las variantes que surgieron en humanos arcaicos y que no fueron aportadas a los humanos modernos no pueden estudiarse en la gente actual. Sin embargo, estas variantes se pueden estudiar en sistemas modelo.
Por ejemplo, las variantes se pueden cambiar experimentalmente al estado ancestral o al estado visto en humanos arcaicos mediante la edición del genoma. Los efectos de estas variantes pueden luego estudiarse en cultivos celulares u organoides que imiten parcialmente la fisiología de los órganos humanos. Otra posibilidad es introducir variantes genéticas humanas modernas o arcaicas en los genomas de ratones y estudiar sus efectos en el organismo.
Sin embargo, el estudio de los portadores reales de las variantes arcaicas suele resultar muy informativo. Para que esto sea posible se deben cumplir varios requisitos.
Un requisito es que las variantes arcaicas deben ocurrir en frecuencias lo suficientemente grandes como para ser detectadas en estudios de asociación o cohortes de población donde esté disponible información genética y fenotípica. Debido a que tales estudios y cohortes se han generado principalmente en poblaciones de ascendencia europea, hasta la fecha se han estudiado más variantes neandertales que denisovanas.
Sin embargo, se están estableciendo cada vez más grandes biobancos en Asia (por ejemplo, BioBank Japan, Tohoku Medical MegaBank y The Korean Genome and Epidemiology Study), lo que abre posibilidades para estudiar también las contribuciones genéticas de Denisova.
Otro requisito para estudiar variantes genéticas arcaicas en los humanos actuales es que deben tener efectos fenotípicos lo suficientemente grandes como para ser detectados. El efecto de una única variante suele ser pequeño y puede resultar imposible de detectar en cohortes de unas pocas decenas o cientos de miles de individuos.
Afortunadamente, es relativamente probable que algunos tipos de variantes genéticas tengan efectos fenotípicos que puedan estudiarse. Por ejemplo, las variantes que afectan la expresión o las secuencias de aminoácidos de enzimas o proteínas que transportan moléculas a través de las membranas pueden tener efectos que afecten directamente a procesos mensurables como la catálisis de una reacción química o la acumulación de moléculas en las células.
Sin embargo, muchos rasgos de interés son genéticamente complejos, es decir, afectados por muchas variantes genéticas. Además, las variantes arcaicas involucradas en rasgos complejos pueden ser difíciles de detectar, porque sus efectos pueden depender de variantes arcaicas en otras partes del genoma que pueden no existir en los humanos actuales o ser muy raras.
A continuación, se analizan las variantes genéticas que surgieron en los neandertales, luego se analizan las variantes que surgieron en los denisovanos y, finalmente, se examinan las variantes que surgieron en los humanos modernos.
Variantes genéticas que surgieron entre los neandertales
Para los neandertales, se encuentran disponibles tres genomas de alta calidad y una docena de genomas de menor calidad. A pesar de estas pequeñas cantidades, su edad varía desde aproximadamente 130.000 años hasta aproximadamente 45.000 años y cubren gran parte de la distribución neandertal desde Europa occidental hasta el sur de Siberia.
Por lo tanto, es muy probable que cualquier variante derivada de los neandertales y presente en forma homocigótica en todos los genomas neandertales disponibles haya estado presente con alta frecuencia entre las poblaciones de neandertales tardíos. La mayoría de estas variantes se han estudiado porque también ocurren en los humanos actuales como resultado del flujo genético. A continuación se analizan algunas variantes que surgieron en los neandertales y afectan a diversos aspectos de la fisiología humana.
Metabolismo
Uno de los primeros segmentos de DNA de Neandertal en los humanos actuales para el que se describió un efecto fenotípico se encuentra en el cromosoma 17. Este segmento de DNA porta variantes reguladoras que afectan la expresión de la proteína transportadora de piruvato SLC16A11 en el hígado y sustituciones de aminoácidos que disminuyen las interacciones de SLC16A11 con chaperonas necesarias para su expresión en la superficie celular. La expresión reducida de SLC16A11 en la superficie celular da como resultado cambios en el metabolismo de los ácidos grasos y lípidos asociados con un mayor riesgo de diabetes tipo 2.
Si bien estas variantes se ubican en segmentos de DNA de diferentes longitudes (definidos aquí y a continuación como una asociación de tipo Neandertal), alelos en la población de r2 > 0,8 en una escala entre 0 y 1), todos comparten un segmento de DNA de 73 kb.
También se han descrito algunas otras variantes del gen neandertal con consecuencias metabólicas de importancia médica, por ejemplo, una que aumenta el riesgo de desnutrición proteico-calórica y otras que afectan el metabolismo de fármacos de uso común.
Órganos sensoriales
Otro segmento de DNA neandertal con efectos fenotípicos en los humanos actuales se encuentra en el cromosoma 2 y codifica el canal de sodio SCN9A (Nav1.7), que inicia la sensación de dolor en las terminaciones nerviosas periféricas.
En los neandertales, esta proteína porta tres cambios de aminoácidos, y la combinación de dos de estos cambios de aminoácidos acorta el tiempo que el canal permanece refractario después de haber sido activado, provocando que esté abierto por más tiempo después de ser estimulado.
Esto puede hacer que las células nerviosas sean más sensibles. Aproximadamente el 0,4% de las personas en el Reino Unido portan un fragmento de DNA de 23 kb (r2 > 0,8) con la versión neandertal de SCN9A.
Estos portadores informan haber experimentado más dolor que los no portadores en los cuestionarios. Este aumento corresponde aproximadamente al aumento del dolor que experimentan las personas con cada 8 o 9 años adicionales de vida.
Dado que las personas que expresan la versión neandertal de SCN9A en forma heterocigótica experimentan más dolor, es tentador sugerir que los neandertales, que portaban esta versión de la proteína en forma homocigótica, eran más sensibles al dolor que las personas actuales.
De ser así, esto podría incluso haber sido una ventaja selectiva dado que las mutaciones bialélicas de pérdida de función en SCN9A, que causa insensibilidad congénita al dolor, reducen la esperanza de vida.
Gestación
Un fragmento de DNA de 56 kb de origen neandertal en el cromosoma 11 codifica el receptor de progesterona, que, activado por la hormona esteroide progesterona, funciona como un factor de transcripción que regula la expresión genética.
Presenta varias diferencias con otras versiones de este fragmento, incluida una variante de aminoácido en la proteína codificada y la inserción de un elemento Alu, un elemento transponible activo en humanos y otros primates.
En algunas poblaciones, la versión neandertal del gen se presenta con una frecuencia de portadores de hasta el 21%. Dado que se asocia con un mayor riesgo de nacimientos prematuros en los humanos actuales, se ha sugerido que representa una desventaja evolutiva para los neandertales, especialmente en ausencia de atención médica moderna.
Sin embargo, las variantes de Neandertal también se asocian con una disminución de aproximadamente un 15% en el riesgo de sufrir hemorragias y abortos espontáneos al principio del embarazo, así como con tener más hermanos.
Por lo tanto, es tentador especular que representa una compensación evolutiva en la que las variantes neandertales rescatan embarazos que de otro modo habrían resultado en abortos espontáneos, pero el precio pagado es que algunos de estos embarazos resultan en nacimientos prematuros.
En particular, se han aportado dos versiones diferentes del gen del receptor de progesterona de Neandertal a los humanos modernos, y ambas han aumentado en frecuencia, como lo demuestra un aumento en su aparición en restos esqueléticos de individuos durante los últimos 10.000 años.
Ambas versiones neandertales dan como resultado una mayor expresión del receptor de progesterona y, por lo tanto, pueden mediar un mayor efecto de la progesterona durante los embarazos.
Esto es compatible con el hallazgo de que la administración de progesterona reduce las tasas de aborto espontáneo en mujeres que previamente experimentaron abortos espontáneos y sugiere que el aumento de los efectos de la progesterona mediados por niveles hormonales más altos o por niveles más altos de receptores puede proteger los embarazos en riesgo.
Sistema Inmunológico
Las enfermedades infecciosas son un factor selectivo importante y, por tanto, influyeron en el destino de muchas variantes genéticas arcaicas.
Por ejemplo, es particularmente probable que los segmentos de DNA de Neandertal que portan genes que codifican proteínas que interactúan con los virus hayan aumentado a altas frecuencias y, por lo tanto, es probable que hayan sido ventajosos para los antepasados de los europeos actuales.
De manera similar, las variantes neandertales que influyen en la transcripción de genes implicados en las respuestas, especialmente a los virus, se han introducido con frecuencia en las poblaciones actuales.
Además, las regiones genómicas que contienen genes de inmunidad innata parecen albergar más variantes neandertales que el resto de la población en su genoma codificante. Algunas variantes del gen neandertal que influyen en la respuesta inmune a los patógenos también pueden aumentar el riesgo de enfermedades autoinmunes.
Un ejemplo de una contribución inmunológica arcaica es un segmento de DNA de 143 kb de largo en el cromosoma 4. Contiene tres genes que codifican receptores tipo Toll, que se expresan en células dendríticas y macrófagos y reconocen características conservadas de los microbios y activan respuestas inmunes innatas. En los humanos modernos se encuentran dos variantes neandertales diferentes y una variante denisovana de esta región. Dado que se han aportado y persistido allí a los humanos modernos tres variantes arcaicas diferentes, parece que han sido ventajosas.
Las variantes arcaicas aumentan la expresión de los receptores y se asocian con una mayor resistencia a las infecciones por Helicobacter pylori. Como es el caso de otras variantes que afectan las respuestas inmunes, estas variantes difieren en frecuencia entre las poblaciones actuales, lo que sugiere que la selección local de patógenos puede haberlas afectado.
Un ejemplo sorprendente de variantes arcaicas que afectan la respuesta a las infecciones es un segmento de DNA neandertal de 49 kb en el cromosoma 3. Lleva 13 sustituciones de nucleótidos y confiere un riesgo casi dos veces mayor de necesitar ventilación mecánica o morir a causa de una infección por síndrome respiratorio agudo severo. coronavirus 2 (SARS-CoV-2).
El mecanismo subyacente puede implicar no sólo la expresión de LZTFL1, uno de los genes codificados en el fragmento, sino también la expresión de otros genes.
Las variantes neandertales en el cromosoma 3 también influyen en la expresión de otros genes de la región, en particular CCR5, que codifica un receptor de quimiocina que sirve como correceptor del virus de la inmunodeficiencia humana (VIH).
Se expresa menos en individuos que portan el segmento de DNA de Neandertal, lo que lleva a una reducción de aproximadamente el 25% del riesgo de infectarse con el VIH. Así, aunque este segmento de neandertal sea seleccionado negativamente en la pandemia de SARS-CoV-2, tiene efectos positivos en otros contextos. Este parece haber sido el caso también en el pasado.
Mientras que la variante neandertal ha alcanzado frecuencias de portadores cercanas al 60% en el sur de Asia, está casi ausente en el este de Asia, lo que quizás sugiere que otras enfermedades infecciosas en el pasado han causado que la frecuencia del fragmento de DNA de Neandertal aumente en el sur de Asia y disminuya en el este de Asia.
Los estudios de asociación de la gravedad de la enfermedad COVID-19 también han revelado que un segmento de DNA de 75 kb de largo en el cromosoma 12, que anteriormente se había demostrado que derivaba de los neandertales, protege contra enfermedades graves.
Lamentablemente, el tamaño de su efecto es casi cinco veces menor que el de la variante de riesgo neandertal en el cromosoma 3. El segmento del cromosoma 12 codifica tres genes que sintetizan moléculas implicadas en la actividad de una RNasa que degrada el RNA bicatenario.
La variante neandertal codifica la forma de empalme ancestral de uno de los genes, que se localiza en las estructuras de membrana donde se replica el virus SARS-CoV-2 y, por lo tanto, presumiblemente es más eficiente para eliminar las células infectadas por este y otros virus de RNA.
El seguimiento de esta variante a lo largo del tiempo entre 1.641 genomas humanos antiguos y modernos ha demostrado que su frecuencia ha aumentado dos veces en el pasado en las poblaciones europeas, probablemente en respuesta a enfermedades infecciosas.
El hecho de que muchas variantes genéticas de los neandertales afecten a fenotipos relacionados con enfermedades infecciosas puede no ser una coincidencia.
Las infecciones son un factor importante que afecta a las poblaciones humanas y que cambia con especial rapidez con el tiempo. Las poblaciones humanas arcaicas en Eurasia probablemente enfrentaron distintos desafíos patógenos, lo que requirió adaptaciones en sus sistemas inmunológicos.
Estas adaptaciones locales a los patógenos son un fenómeno bien documentado en los humanos modernos, siendo un ejemplo destacado la relación entre la anemia falciforme y la resistencia a la malaria.
Hay pocas razones para dudar de que los humanos arcaicos también sufrieron presiones evolutivas similares. Las diferencias en los sistemas inmunológicos entre los humanos arcaicos y modernos podrían ser una manifestación particularmente clara de su prolongada separación geográfica.
Rasgos complejos
La mayoría de los rasgos humanos, como la altura o las capacidades cognitivas, varían continuamente en la población y están influenciados por muchas variantes genéticas en muchas partes del genoma, así como por el medio ambiente.
Estudiar cómo el flujo genético de humanos arcaicos ha afectado rasgos tan complejos es exigente, sobre todo porque el tamaño del efecto de cada variante genética es generalmente pequeño.
Por lo tanto, los análisis actuales no se basan en asociaciones directas entre variantes individuales y fenotipos complejos.
En cambio, se investiga si todas las variantes neandertales o denisovanas en una población, cuando se combinan, tienden a influir en un rasgo complejo en una dirección particular o representan una parte de la variación en el riesgo de una enfermedad compleja.
Estos estudios han demostrado, por ejemplo, que los alelos neandertales explican una fracción significativa de la variación en el riesgo de depresión y lesiones cutáneas inducidas por el sol.
Algunos estudios también han examinado si existe una representación excesiva o insuficiente de variantes arcaicas que influyen en un determinado rasgo.
En general, se descubrió que los rasgos complejos estaban menos influenciados por la ascendencia neandertal de lo esperado. De 405 rasgos complejos, los rasgos dermatológicos fueron los más influenciados, mientras que los rasgos cognitivos fueron los menos influenciados por el DNA neandertal. Esta última observación es compatible con la observación de que la expresión de genes en el cerebro está menos influenciada por variantes neandertales que la expresión de genes en otros órganos.
La expresión génica
Muchos rasgos complejos pueden verse influenciados por los niveles de expresión genética. Un estudio ha demostrado que en los individuos que portan una variante neandertal y una variante moderna de un gen, las variantes neandertales tienden a expresarse menos que las variantes humanas modernas.
Esto es particularmente pronunciado en los testículos y el cerebro, especialmente en el cerebelo y los ganglios basales, lo que sugiere que la selección contra las secuencias reguladoras neandertales es particularmente fuerte en esos tejidos.
Esto es compatible con la influencia relativamente baja de las variantes neandertales en los rasgos cognitivos.
Las variantes arcaicas más antiguas fueron más toleradas entre los humanos modernos que las variantes arcaicas más recientes.
Es probable que las variantes compartidas entre un neandertal siberiano y un neandertal de Croacia sean más antiguas que las variantes encontradas en solo uno de estos individuos, mientras que las variantes compartidas entre neandertales y denisovanos probablemente sean incluso más antiguas.
En el caso de la regulación genética, se ha demostrado que las variantes arcaicas que regulan positivamente la expresión de los genes están infrarrepresentadas en las poblaciones actuales, a excepción de las variantes compartidas entre neandertales y denisovanos.
Por tanto, las variantes que persistieron en grupos arcaicos durante mucho tiempo pueden tener efectos más benignos en los humanos modernos que las variantes que se originaron más recientemente en los neandertales.
Esto podría deberse a que los grupos arcaicos tuvieron más tiempo para eliminar variantes nocivas mediante la selección purificadora.
También es posible que las variantes arcaicas más antiguas fueran más compatibles con rasgos ancestrales compartidos con los ancestros de los humanos modernos.
Además, las variantes genéticas nocivas pueden haberse acumulado con especial facilidad en los neandertales tardíos porque el tamaño de su población era pequeño, lo que permitió que las variantes ligeramente nocivas se hicieran frecuentes con mayor facilidad.
Variantes genéticas que surgieron entre los denisovanos.
Como actualmente solo se dispone de un único genoma de alta calidad de un denisovano, se sabe poco sobre la frecuencia de una variante particular entre ellos.
Además, se conocen relativamente pocos ejemplos de contribuciones genéticas denisovanas con consecuencias fenotípicas. La razón principal es que hay pocos estudios de asociación y biobancos disponibles en Asia, una situación que afortunadamente está cambiando rápidamente.
Adaptación a la gran altitud
Un ejemplo sorprendente de la influencia denisovana en las poblaciones actuales es un segmento de DNA denisovano de 33 kb en el cromosoma 2 que ocurre con una frecuencia alélica de más del 80% entre los tibetanos, mientras que está ausente o es muy raro en otras poblaciones asiáticas.
Codifica EPAS1 , un factor de transcripción inducido por la hipoxia que interviene en la adaptación a niveles bajos de oxígeno. Los denisovanos estaban presentes en el altiplano tibetano; Por lo tanto, algunos de ellos pueden haberse adaptado a la vida en grandes altitudes y presumiblemente contribuyeron con esta predisposición genética a los humanos modernos cuando llegaron a la región.
Sería interesante estudiar la expresión del gen EPAS1 en aymaras y gente del altiplano boliviano.
Adaptación al frío y morfología facial.
Otro ejemplo de contribución genética denisovana es un segmento de 28 kb en el cromosoma 1, que porta los genes WARS y TBX15.
Está presente en casi el 100% de los inuit groenlandeses y en varias otras poblaciones. Las variantes denisovanas afectan la expresión de genes que pueden influir en la adaptación a las bajas temperaturas, posiblemente induciendo grasa parda.
Curiosamente este segmento también se ha asociado con el grosor del labio superior y su protrusión. Sin embargo, la variante genética en el segmento de 28 kb más fuertemente asociada con la morfología de los labios (rs3790553) no está presente en el genoma denisovano secuenciado hasta la fecha.
Esto no descarta que otra variante de Denisova pueda estar asociada con el rasgo o que esta variante pueda estar presente en un genoma de Denisova no secuenciado.
Sin embargo, advertimos que en este y otros casos, un segmento de DNA arcaico podría haberse recombinado con una variante humana moderna asociada con el rasgo poco después de su introducción en la población humana moderna. También es posible que haya surgido una variante genética en el segmento de DNA arcaico después de su introducción en los humanos modernos.
Variantes genéticas que surgieron entre los humanos modernos.
Los cambios genéticos que ocurrieron en el linaje humano moderno y que están presentes en casi todas las personas hoy en día (es decir, son “fijos”) diferencian a los humanos modernos de los humanos arcaicos.
Estos cambios son interesantes porque podrían ser la base de diferencias biológicas que pueden ser importantes para el fenotipo humano moderno. Sin embargo, a menudo no está claro hasta qué punto un solo cambio de este tipo podría causar un fenotipo.
Sin embargo, parece que muchos de los cambios que se han producido en el linaje humano moderno y que han afectado, por ejemplo, a la expresión genética, pueden haber sido más beneficiosos para los humanos modernos que los cambios que se produjeron en los linajes arcaicos.
Esto lo sugiere la observación de que los segmentos de DNA arcaicos que afectan la expresión genética y otros rasgos tienden a enriquecerse con variantes ancestrales en lugar de variantes derivadas de humanos arcaicos.
Otro factor que complica la situación es que muchos rasgos de interés pueden ser complejos y, por tanto, estar influidos por cambios genéticos que no han alcanzado la fijación. Por ejemplo, la altura del cuerpo está influenciada por la variación en muchas posiciones del genoma.
Si suponemos que existe una presión de selección que favorece a los individuos altos en una población, entonces es posible que la altura de los individuos aumente porque los alelos que aumentan la altura en muchas posiciones diferentes del genoma se vuelven más frecuentes en la población sin que ninguno de ellos se vuelva muy grande,frecuente o presente en todos los individuos.
Aún así, algunas variantes individuales que surgieron en los humanos modernos pueden tener efectos que pueden identificarse y estudiarse.
Por ejemplo, las sustituciones de nucleótidos que se produjeron en los sitios de unión de los factores de transcripción en los humanos modernos pueden cambiar la expresión de los genes. Otros ejemplos son los cambios que afectan la estructura de las enzimas, algunos de los cuales analizamos a continuación.
Biosíntesis de purinas
Los cambios que causan sustituciones de aminoácidos en las enzimas son particularmente susceptibles de investigación porque la función de la enzima puede estudiarse in vitro y las concentraciones de sustratos y productos pueden determinarse en células y tejidos.
Un ejemplo es la adenilosuccinato liasa (ADSL), una enzima que cataliza dos pasos en la síntesis de purinas, moléculas que son componentes básicos del DNA y el RNA y que tienen muchas otras funciones importantes en la célula. ADSL lleva una sustitución de aminoácidos que ocurrió en los humanos modernos y se encuentra en casi todas las personas hoy en día. Reduce la estabilidad de la enzima.
La versión moderna de la enzima hace que se sinteticen niveles más bajos de purinas en las células. Esto se demostró mediante la introducción experimental de la versión ancestral de la enzima que los neandertales y los denisovanos llevaban a las células humanas en cultivos de tejidos y la versión humana moderna de la enzima en ratones.
En comparación con los simios, los tejidos humanos muestran niveles más bajos de purinas, y esta diferencia se explica en gran medida por la sustitución de aminoácidos en el ADSL.
Sin embargo, no está claro qué consecuencias tiene esto a nivel del organismo. Una forma de abordar este problema es estudiar ratones u otros animales modelo en los que se haya introducido la sustitución derivada, similar a la humana moderna.
Sin embargo, una advertencia obvia es que el trasfondo genético del ratón es diferente al de los humanos. Otro enfoque es encontrar personas raras que porten la versión ancestral de ADSL en la actualidad.
Estrés oxidativo
La enzima glutatión reductasa es importante para mantener un ambiente intracelular reducido y prevenir el estrés oxidativo. En la mayoría de los humanos actuales, la glutatión reductasa lleva una sustitución de aminoácidos que no se observa en los humanos arcaicos y otros primates.
Cuando se expresa in vitro, la enzima ancestral produce más radicales de oxígeno en ausencia de su sustrato glutatión oxidado, lo que sugiere que puede ser menos eficiente para prevenir el estrés oxidativo cuando las células no están expuestas al estrés oxidativo. La versión ancestral de la enzima todavía está presente en algunas personas hoy en día debido al flujo genético de los neandertales, y su efecto puede estudiarse utilizando los datos del BioBank del Reino Unido, donde el 0,06% de los participantes son portadores de esta variante.
De hecho, la versión ancestral se asocia con un mayor riesgo de aterosclerosis y enfermedad inflamatoria intestinal, enfermedades que tienen un componente inflamatorio que puede verse exacerbado por el estrés oxidativo. Esto respalda la hipótesis de que la versión humana moderna de la enzima proporciona una mejor protección contra el estrés oxidativo.
EMPALME DE NUCLEÓTIDOS
La proteína NOVA1 participa en el empalme y procesamiento de los extremos 3 ‘de las transcripciones. Lleva una sustitución de aminoácidos en los humanos modernos.
Los organoides cerebrales generados a partir de células madre humanas que han sido modificadas genéticamente para portar la variante ancestral mostraron diferencias en morfología, expresión de proteínas sinápticas y electrofisiología.
Si bien este experimento es un enfoque valioso para estudiar la relevancia fisiológica de la diferencia genética, los efectos observados pueden deberse a eliminaciones del gen objetivo que a menudo ocurren como un efecto secundario de la edición del genoma. Curiosamente, la versión ancestral de NOVA1 ocurre en al menos cuatro individuos en las bases de datos actuales, incluido el programa Trans-Omics for Precision Medicine (TOPMed), donde hay otros datos y fenotipos disponibles. Así, se podría estudiar el efecto de la variante ancestral en portadores humanos.
Neurogénesis
Tres proteínas implicadas en la segregación cromosómica durante la división celular, KIF18A, KNL1 y SPAG5, llevan una, dos y tres sustituciones de aminoácidos modernas específicas del ser humano, respectivamente. La introducción de estos seis cambios en ratones (solos y en combinaciones) reveló que los cambios humanos modernos en Knl1 y Kif18A prolongan una parte de la mitosis, la metafase, cuando los cromosomas se alinean antes de separarse en las dos células hijas.
Esta prolongación se observa en los progenitores apicales que generan neuronas durante el desarrollo cerebral. Cuando las tres variantes ancestrales se introdujeron en KNL1 y KIF18A en células madre humanas que luego se usaron para generar organoides cerebrales, se observó un acortamiento de la metafase.
En particular, la metafase acortada en los organoides con variantes ancestrales es similar a la diferencia en la longitud de la metafase que se observa entre los organoides de chimpancés y humanos. La prolongación de la metafase en los humanos modernos parece correlacionarse con una reducción en el número de cromosomas mal segregados.
Esto sugiere que estos cambios pueden aumentar la precisión de la segregación cromosómica en la neurogénesis temprana. Curiosamente, la versión humana moderna de KNL1 se encuentra en algunos neandertales tardíos como resultado del flujo genético de ancestros humanos modernos, lo que se suma a la evidencia de que los contactos entre las tres formas de humanos ocurrieron en numerosas ocasiones.
En los humanos modernos, la enzima tipo transcetolasa 1 (TKTL1) en la vía de las pentosas fosfato lleva una sustitución de aminoácidos.
Cuando las versiones humanas arcaicas y modernas de las proteínas se sobreexpresan en los cerebros en desarrollo de ratones o hurones, la versión humana moderna da como resultado la generación de más células de glía radial basal.
Por el contrario, los organoides del cerebro humano generados a partir de células madre que portan la forma ancestral de TKTL1 generan menos células de glía radial basal y menos neuronas. Esto sugiere que esta sustitución de aminoácidos provoca cambios metabólicos que afectan la neurogénesis en las primeras etapas del desarrollo.
Tanto los cambios en KNL1 y KIF18A que afectan la segregación cromosómica como el cambio en TKTL1 que afecta la generación de precursores neuronales tienen efectos durante el desarrollo temprano del cerebro.
Se necesita más trabajo para dilucidar si estos efectos tienen alguna consecuencia para el cerebro adulto, ya que otros mecanismos pueden compensarlo.
Variantes ancestrales en la gente actual
Históricamente, las personas de ascendencia europea han sido los principales sujetos de los estudios genómicos.
Por lo tanto, las listas iniciales de cambios genéticos que se pensaba que existían en todos los humanos actuales estaban incompletas, ya que solo consideraron algunas de las poblaciones del mundo.
A medida que se secuencian más genomas humanos de más partes del mundo, en algunas poblaciones se encuentran variantes genéticas ancestrales que se pensaba que estaban ausentes en los humanos actuales. Por el contrario, las poblaciones de ascendencia europea portan variantes ancestrales que no existen en casi ningún otro lugar.
Hay dos razones por las que hoy en día pueden aparecer variantes ancestrales. En primer lugar, algunas variantes ancestrales han persistido desde que los ancestros comunes de los humanos modernos y arcaicos vivieron hace 600.000 años.
Esto es especialmente frecuente en poblaciones de África, donde la diversidad genética es mayor que fuera de África. En segundo lugar, los neandertales y los denisovanos han aportado variantes ancestrales a los pueblos actuales.
Es probable que las poblaciones con niveles más altos de ascendencia arcaica, por ejemplo en Oceanía, tengan niveles particularmente altos de variantes ancestrales reintroducidas.
La Figura 3 ilustra estos dos escenarios utilizando genomas de 25 individuos Khoe-San (un grupo diverso de pueblos indígenas del sur de África) y 25 individuos Ayta (un grupo indígena de Filipinas). De las 113 variantes que se consideraron casi fijas entre la gente actual (ver https://bioinf.eva.mpg.de/catalogbrowser), 42 se encuentran en su forma ancestral en Khoe-San, Ayta o ambos (Figura 3).
Un ejemplo sorprendente es TKTL1. La versión ancestral de TKTL1 existe en los humanos actuales con una frecuencia variante general de aproximadamente el 0,03%. Sin embargo, en Khoe-San, su frecuencia ronda el 32%. La alta frecuencia de la variante ancestral TKTL1 es probablemente un ejemplo de una variante genética que se ha perdido en la mayoría de los demás grupos.
A medida que los proyectos de secuenciación del genoma en curso y futuros incluyan poblaciones geográficamente más diversas, es probable que se encuentren versiones aún más ancestrales de cambios genómicos que actualmente solo se conocen en sus formas derivadas.
En última instancia, cuando los biobancos que contienen no sólo información individual sobre la variación genómica sino también información fenotípica incluyan grupos más diversos y poco estudiados anteriormente, permitirán la investigación de muchas más variantes arcaicas y sus efectos sobre fenotipos fisiológicamente relevantes.
Una visión combinatoria de la modernidad humana
La aparición de variantes ancestrales raras en casos en los que la mayoría de las personas portan variantes derivadas plantea dudas sobre cómo definir a los humanos modernos desde una perspectiva genética.
Para obtener una perspectiva sobre esto, puede ser útil considerar cómo los paleoantropólogos definen a los neandertales y a los humanos modernos basándose en la morfología esquelética utilizando características como la robustez de su esqueleto, la presencia de arcos superciliares prominentes y cráneos alargados con “moños” occipitales. La mayoría de estas características se derivan de los neandertales.
Sin embargo, estas características también se pueden encontrar en los humanos modernos. Por ejemplo, hoy en día algunas personas tienen esqueletos tan robustos o arcos superciliares tan prominentes como los neandertales. Sin embargo, sólo los neandertales presentan una combinación de todas o la mayoría de estas características.
De manera similar, la base genética del fenotipo humano moderno debe verse como una combinación de características genéticas derivadas, donde no todas las características están presentes en todos los humanos modernos.
Más bien, algunas características modernas derivadas pueden existir en sus formas ancestrales en algunas personas hoy en día, ya sea porque han persistido a partir del ancestro común de los humanos arcaicos y modernos o debido al flujo de genes arcaicos.
Por lo tanto, desde una perspectiva genética, se puede definir a los humanos modernos como portadores de combinaciones de variantes derivadas, que son comunes pero no están presentes en todos nosotros hoy en día (Figura 2).
Por el contrario, algunas variantes genéticas derivadas típicas de los humanos modernos están presentes en algunos humanos arcaicos que vivieron lo suficientemente tarde como para portar variantes que fueron introducidas en la población arcaica a partir de humanos modernos, como lo ilustra la forma derivada de KNL1 observada en algunos neandertales.
Por supuesto, los humanos modernos también pueden exhibir algunos cambios que son casi completamente fijos (si se ignoran las muy raras retromutaciones).
Un ejemplo es una sustitución en el gen AHR que cambia un aminoácido en el receptor de aril hidrocarburo y reduce su capacidad para inducir la expresión de enzimas que metabolizan los hidrocarburos aromáticos. Hasta donde sabemos, esta variante no se ha visto en ningún ser humano actual hasta la fecha.
Hay algunas regiones genómicas en los humanos actuales que carecen de variantes aportadas por los neandertales y los denisovanos. Están particularmente enriquecidos en variantes fijadas entre los humanos modernos porque apenas contienen contribuciones genéticas arcaicas. Estas regiones genómicas pueden ser de particular interés para comprender la singularidad del ser humano moderno.
Conclusiones y perspectivas
Los genomas de los neandertales y los denisovanos han demostrado que tuvieron ancestros comunes con los humanos modernos hace unos 600.000 años.
Por el contrario, el antepasado de todos los humanos actuales existió quizás hace unos 300.000 años. Como resultado, sólo entre el 1,5% y el 7% del genoma están formados por regiones donde los genomas arcaicos quedan fuera de la variación de la gente actual.
Estas regiones albergan variantes genéticas cuya frecuencia difiere drásticamente entre los humanos modernos y arcaicos. Sin embargo, las variantes en otras regiones del genoma también pueden diferir entre estos grupos.
Es probable que las diferencias en ambos tipos de regiones del genoma sean importantes para el fenotipo humano moderno. Desde una perspectiva genética, los humanos modernos se definen mejor como una combinación de características genéticas en la que cada individuo porta la mayoría, pero no necesariamente todas, de estas características genéticas.
Esta “visión combinatoria” de lo que constituye un ser humano moderno no niega el hecho de que algunos cambios genéticos individuales pueden ser funcionalmente más importantes que otros.
De hecho, es probable que una “combinación explosiva” de varios o muchos cambios importantes se juntaran y se hicieran frecuentes en la población que se convirtió en el antepasado de los humanos modernos.
Estos cambios pueden haber sido la base genética que permitió a los humanos modernos embarcarse en una trayectoria histórica radicalmente diferente de otras formas humanas que existieron antes y contemporáneamente con los humanos modernos. Un gran desafío para el futuro es identificar estos cambios genómicos.
El flujo genético entre humanos arcaicos y modernos ofrece una manera de estudiar las consecuencias fisiológicas de muchas de las variantes típicas de los humanos modernos y arcaicos.
En el caso de variantes que cambiaron en los humanos modernos, la mezcla entre los grupos a menudo introdujo las versiones ancestrales en la gente actual.
Sin embargo, las variantes introducidas por el flujo de genes arcaicos suelen ser raras, lo que limita nuestra capacidad para estudiarlas. Una perspectiva prometedora es que los biobancos se vuelvan no sólo más grandes sino también más diversos en términos de la ascendencia de sus participantes.
Esto es importante, ya que las variantes que son raras en poblaciones grandes en algún momento habrán alcanzado frecuencias apreciables en poblaciones más pequeñas donde la deriva genética aleatoria juega un papel más importante que en poblaciones más grandes . Por lo tanto, los efectos fenotípicos de algunas variantes ancestrales pueden estudiarse potencialmente en poblaciones pequeñas.
Finalmente, es importante tener en cuenta que cuando las variantes ancestrales se asocian con efectos durante el desarrollo o en individuos adultos, dichas variantes ancestrales no son en ningún sentido “primitivas” o “patológicas”. Funcionaron bien durante cientos de miles de años en humanos arcaicos sanos que estaban estrechamente relacionados con los humanos modernos y presumiblemente la mayoría o todos ellos funcionan bien en las personas de hoy.
Figura 1.Ilustración esquemática de la historia de los humanos arcaicos y modernos y la evolución de la secuencia de DNA.
Se resaltan las mutaciones derivadas. La aparición de flujo de genes entre grupos se ilustra con flechas. Los grupos arcaicos aportaron variantes tanto derivadas como ancestrales a los humanos modernos. Tenga en cuenta que el alcance, el número de eventos de flujo de genes y cuándo ocurrieron sólo se conocen parcialmente.
Figura 4. Ilustración esquemática de los cromosomas actuales y la “visión combinatoria” de la modernidad genética humana
En este ejemplo, siete cromosomas que porta la gente de hoy en día portan siete variantes genéticas que son frecuentes entre los humanos modernos. Tres de ellos (variantes 2, 3 y 5, flechas) se encuentran en todos los cromosomas.
Los demás ocurren en muchos cromosomas, pero no en todos, ya sea porque las variantes ancestrales han persistido en la población humana moderna (variantes 1 y 6) o porque los neandertales contribuyeron con variantes ancestrales a los humanos modernos (variantes 4 y 7). Sin embargo, todos los cromosomas (y por tanto todos los individuos) portan casi todas las variantes que juntas definen a los humanos modernos desde una perspectiva genética.
Figura 3 Las variantes genéticas humanas modernas “únicas” se presentan en su forma ancestral en algunos pueblos actuales
(A) Mapa que ilustra cómo los humanos modernos se originaron en África y se extendieron por África y Eurasia, mezclándose (signos de exclamación) con los neandertales (azul) en Eurasia occidental y los denisovanos (rojo) en Eurasia oriental.
(B) Las versiones ancestrales de 42 de 113 variantes de cambio de proteínas que se consideraban casi fijas (ver https://bioinf.eva.mpg.de/catalogbrowser) se pueden encontrar en 25 individuos de Khoe-San en África meridional (amarillo)78 y 25 individuos de Ayta en Filipinas (verde). aa, sustitución de aminoácidos; AAF, frecuencia de alelos ancestrales.