Ronald Palacios Castrillo
Resumen
Las náuseas y los vómitos (NVP) afectan a la mayoría de las mujeres embarazadas. En el extremo grave del espectro clínico, la hiperemesis gravídica (HG) puede poner en peligro la vida.
La enfermedad está plagada de conceptos erróneos que han ralentizado el progreso y han dejado a las mujeres sin tratamiento adecuado.
En este documento, se presentan avances científicos recientes que disipan los mitos comunes asociados con la HG relacionados con los resultados, la etiología y la evolución de la madre y la descendencia.
=> Recibir por Whatsapp las noticias destacadas
Ahora hay pruebas sólidas de que (i) la HG se asocia con malos resultados, (ii) se ha identificado una causa común de NVP y HG, y (iii) la NVP es probablemente un mecanismo evolutivo protector que ocurre en todo el reino animal pero que no existe. ya no es necesario para la supervivencia humana.
Por lo tanto, es alentador que finalmente estemos a punto de probar tratamientos que puedan poner fin al sufrimiento innecesario.
En Detalle
Descripción general de HG
La mayoría de los embarazos se ven afectados por la NVP y recientemente se ha dilucidado la causa principal de la NVP . Aunque se le da el nombre inapropiado común de “náuseas matutinas”, generalmente no se limitan a la mañana.
La NVP afecta aproximadamente al 70% de los embarazos y a más del 24% de las mujeres embarazadas en los EE. UU. se les recetan medicamentos antieméticos . Cuando la afección se encuentra en el extremo grave del espectro clínico, a los pacientes se les diagnostica HG.
La HG afecta entre el 0,3% y el 10,8% de los embarazos y se caracteriza por síntomas de NVP que comienzan temprano en el embarazo y afectan la actividad diaria, con una incapacidad para comer y beber normalmente que generalmente conduce a deshidratación, desequilibrios electrolíticos y pérdida de peso .
Resulta desconcertante que en el caso de HG se haya pasado históricamente por alto el énfasis en una nutrición adecuada durante el embarazo para la salud general de la madre y el bebé. Los pacientes suelen ser dados de alta del hospital con un peso menor que cuando ingresaron.
La afección se asocia con una desnutrición significativa y los pacientes generalmente no pueden tolerar los suplementos prenatales. Las directrices del Colegio Estadounidense de Obstetras y Ginecólogos recomiendan el ácido fólico en lugar de suplementos prenatales como tratamiento de primera línea , lo que sugiere que el ácido fólico es el único nutriente esencial para la salud materna y fetal.
Aunque se han logrado algunos avances gracias a la reciente incorporación de la derivación a un dietista en las directrices del Reino Unido y Australia/Nueva Zelanda, la implementación en todo el mundo probablemente siga siendo un problema . Por lo tanto, la multitud de resultados deficientes asociados con la HG parecen evidentes (Figura 1), pero los proveedores médicosno los reconocen en gran medida .
Hay muchos mitos que contribuyen al tratamiento insuficiente y la falta de progreso para la HG e incluyen conceptos erróneos históricos de que (i) el bebé recibe todo lo que necesita de la madre, (ii) la causa es la hormona del embarazo, la gonadotropina coriónica humana, y (iii) sólo los humanos tienen NVP.
Este artículo revisa nueva evidencia que disipa estos mitos e introduce avances recientes que muestran que la HG tiene efectos duraderos en la madre y el niño, la causa más probable es el factor de diferenciación y crecimiento de la hormona NVP 15 (GDF15), y la condición probablemente dio una ventaja evolutiva en la naturaleza que ahora es superflua para los humanos.
Estos hallazgos están impulsando el desarrollo de nuevas terapias que pueden contribuir a erradicar una de las afecciones del embarazo más comunes, angustiantes e innecesarias.
Resultados adversos
La HG puede poner en peligro la vida y se asocia con resultados adversos maternos, fetales y de la descendencia (Figura 1).
Debido en parte a los registros médicos electrónicos, se ha vuelto cada vez más factible realizar grandes estudios sobre los resultados de la HG y, lo que es más importante, identificar a los niños que han estado expuestos en el útero a la HG, lo que ha dado lugar a nuevos datos longitudinales sobre los efectos de la HG.
Morbilidad y mortalidad materna
Las mujeres embarazadas siguen muriendo a causa de HG. Fue la cuarta causa principal de muerte materna en Botswana en 2019, y este siglo se han notificado muertes en EE. UU. y el Reino Unido debido a tirotoxicosis, tromboembolismo, suicidio, deficiencia de tiamina que provocó daño cerebral o muerte por encefalopatía de Wernicke y problemas electrolíticos graves, alteraciones que resultaron en un paro cardíaco . Las interrupciones terapéuticas del embarazo ocurren en el 6% de los embarazos . La deficiencia materna de vitamina K ha provocado hemorragia intracraneal/muerte fetal .
En el presente estudio de Schoenberg (Trends in Molecular Med. Published:May 22, 2024DOI:https://doi.org/10.1016/j.molmed.2024.04.006), el 26% de las pacientes con HG informaron haber perdido >15% del peso que tenían antes del embarazo y el 22% informaron síntomas que duraron hasta el término, lo que convierte a la HG en una forma de inanición prolongada durante el embarazo con un impacto psicológico grave.
Además, el 26% informó tener ideación suicida, el 18% tenía criterios completos para el trastorno de estrés postraumático y el 37% decidió no volver a quedar embarazada nunca más.
HG es uno de los principales predictores de depresión posparto . Además, los vómitos intensos y prolongados pueden provocar hemorragia retiniana, neumotórax, desgarros esofágicos y fracturas costales . La HG también se asocia con un mayor riesgo de disfunción placentaria y enfermedades hepáticas y renales .
Resultados del nacimiento y morbilidad de la descendencia.
La morbilidad de la descendencia también es significativa, con un riesgo 2,8 veces mayor de parto prematuro antes de las 34 semanas, un riesgo 1,4 veces mayor de bajo peso al nacer y un riesgo 1,2 veces mayor de ingreso a la unidad de cuidados intensivos neonatales.
El riesgo 2,1 veces mayor de defectos del tubo neural en pacientes que no pueden tragar ácido fólico y los informes de dismorfología deficiente de vitamina K y hemorragia intracraneal son evidencia directa de que las deficiencias de nutrientes maternos pueden tener efectos duraderos en el resultado fetal.
Es importante destacar que el riesgo (4,8 veces) de los bebés pequeños para la edad gestacional (PEG) asociado con HG fue mayor que el de la hipertensión crónica, la preeclampsia, el cannabis, el tabaco, la cocaína y la exposición a anfetaminas.
En un estudio de mujeres hospitalizadas por HG, el aumento inadecuado de peso durante el embarazo y la no recuperación del peso previo al embarazo entre las semanas 13 y 18 fueron factores de riesgo para dar a luz a un bebé PEG .
Resultados infantiles
Los estudios anteriores que vinculaban significativamente la HG con resultados adversos en los niños se basaban principalmente en tamaños de muestra <1000 casos, pero recientemente se han publicado varios estudios de gran tamaño (Figura 1).
Entre ellos, dos grandes estudios de cohortes retrospectivos realizados en EE. UU. demostraron que la exposición intrauterina a HG es un factor de riesgo significativo para el trastorno del espectro autista (TEA) . Otro gran estudio informó sobre los resultados de una cohorte estadounidense de >10 000 niños y una cohorte danesa de >2 millones de niños.
En la cohorte de EE. UU., los niños expuestos a HG obtuvieron puntuaciones significativamente más altas en el trastorno por déficit de atención/hiperactividad (TDAH), depresión y problemas sociales, con un aumento general en la puntuación de problemas psiquiátricos que fue un 25% mayor que el de los niños no expuestos.
En la cohorte danesa, se encontró que los niños expuestos tenían diagnósticos significativamente mayores de trastornos emocionales y del comportamiento, TDAH, trastornos de conducta/trastornos de oposición desafiante, trastornos generalizados del desarrollo y TEA.
Los autores del estudio estadounidense y danés informaron una disminución del área/volumen cortical en niños expuestos en el útero a HG y descubrieron que el desarrollo neurológico anormal estaba mediado por un tamaño reducido del cerebro.
El crecimiento de la cabeza fetal en pacientes con HG se asocia positivamente con el aumento de peso materno en la mitad de la gestación, lo que sugiere que la desnutrición relacionada con HG en la primera mitad del embarazo puede afectar el crecimiento y desarrollo del cerebro fetal y explicar el mayor riesgo de retraso en el desarrollo neurológico en la infancia.
Otros resultados adversos en la infancia informados recientemente incluyen un mayor riesgo de cáncer infantil, incluido un riesgo 2,5 veces mayor de neuroblastoma, un riesgo 1,4 veces mayor de morbilidad respiratoria infantil y un mayor riesgo de enfermedad cardiovascular en niños de 3 años.
Es importante destacar que los estudios de resultados infantiles que incluyeron prescripciones encontraron que existían asociaciones independientes de la exposición a los medicamentos y plantearon la hipótesis de que las deficiencias nutricionales son una causa probable .
Por lo tanto, han salido a la luz estudios sobre resultados adversos maternos, fetales e infantiles asociados con la HG. Los nuevos hallazgos sugieren fuertemente que la HG puede tener efectos duraderos en la madre, puede alterar los resultados del parto y puede ser una exposición perjudicial durante el embarazo similar a un teratógeno. En el caso de HG, el bebé no siempre recibe todo lo que necesita de la madre.
Descubrimiento de la hormona NVP GDF15 y NVP/HG
Descubrimiento de GDF15 en el embarazo
En 1997, el gen GDF15 fue clonado por tres grupos, incluido uno que buscaba genes altamente expresados en la placenta que informaron una mayor expresión placentaria de GDF15 que cualquier otro tejido humano fetal o adulto sano analizado, que fue mayor a las 8-9 semanas del inicio que a las 8-9 semanas de del termino.
Luego, en el año 2000, se informó la detección de niveles elevados de GDF15 en el suero de mujeres embarazadas . Posteriormente, se midió GDF15 en 12 momentos durante el embarazo y el parto. El estudio no encontró una asociación con el parto (o la preeclampsia), pero reveló el patrón de los niveles de GDF15 en embarazos sanos.
Específicamente, GDF15 aumenta rápidamente en el primer trimestre, se estabiliza en el segundo trimestre y vuelve a aumentar entre las semanas 24 y 26, con un segundo pico entre las semanas 33 y 35 .
GDF15 y pérdida de apetito
En 2007 se publicó un descubrimiento que vinculaba al GDF15 con el control del apetito . El estudio histórico demostró que muchos tumores sobreexpresaban GDF15 y que los niveles circulantes eran directamente proporcionales a la pérdida de peso asociada a la caquexia.
En modelos de ratón, GDF15 indujo apetito y pérdida de peso que se revirtió bloqueando GDF15. El estudio sugirió reducir el GDF15 como un nuevo tratamiento para la caquexia (una afección con síntomas similares a los de la HG caracterizada por hipofagia y pérdida de peso) y, a la inversa, aumentar el GDF15 para tratar la obesidad.
En 2014, Schoenberg y colegas demostró que el sitio de acción de GDF15 era el rombencéfalo, con una pérdida total de los efectos anoréxicos después de la ablación . Mientras tanto, las compañías farmacéuticas se abalanzaron sobre la molécula en una carrera para encontrar el receptor restringido al rombencéfalo, y en 2017, cuatro grupos separados publicaron el descubrimiento del receptor tipo α de la familia GDNF (GFRAL) y el protooncogén correceptor receptor de tirosina-proteína quinasa. Siguieron programas para desarrollar medicamentos para perder y ganar peso basados en estos hallazgos .
Vínculo genético entre GDF15 y NVP/HG
A principios de 2017, Schoenberg y colaboradores presentó la primera evidencia que vincula GDF15 con HG mediante un estudio de asociación de todo el genoma (GWAS) de >50000 participantes de la investigación de 23andMe, Inc.
Además, encontraron asociaciones significativas con la proteína 7 del factor de unión similar a la insulina (IGFBP7), el receptor de progesterona y el receptor GDF15 GFRAL . También demostramos que los niveles circulantes de GDF15 e IGFBP7 están significativamente elevados en pacientes hospitalizados a las 12 semanas de gestación con HG en comparación con pacientes con NVP normal y sin NVP, pero los niveles son similares a las 24 semanas de gestación.
Un estudio publicado en línea a finales de 2017 (publicado en 2018) respaldó aún más el hallazgo de que se detectan niveles significativamente más altos de GDF15 en embarazos afectados por NVP más grave . Además, otro estudio reveló que los niveles circulantes de GDF15 son significativamente más altos en personas con fetos femeninos, y se informaron náuseas en el 72% de las mujeres con fetos femeninos y en el 42% con fetos masculinos, lo que proporciona una explicación biológica para la observación de una peor NVP en los embarazos. con descendencia femenina .
En 2022 se publicaron los resultados de un segundo estudio genético de Schoenberg y su grupo, utilizando una población separada (>1500 reclutados a través de hyperemesis.org) y utilizando un enfoque de secuenciación del exoma completo.
El único locus significativo fue nuevamente una variante en GDF15. Además, solo hubo una variante dañina que ocurrió en más de diez casos o igual y ningún control, una mutación en GDF15.
Cada participante con la mutación tuvo al menos un embarazo con HG, lo que implica fuertemente una etiología causal de GDF15.
Es cierto que los estudios genéticos incluyeron principalmente participantes blancos de ascendencia europea y, por lo tanto, se debe trabajar más para determinar la generalización de los resultados a otras poblaciones. Con ese fin, es importante señalar que recientemente, la asociación principal con el locus GDF15 se replicó en GWAS que incluían poblaciones asiáticas.
Interacción genética materno-fetal: un mecanismo que afecta la recurrencia
Quizás la pregunta más común que tienen las pacientes después de un embarazo afectado por HG es «¿tendré esto otra vez?», y ~37% de las pacientes con HG limitan el tamaño de la familia por temor a la recurrencia.
Suponiendo que la afección tenga un fuerte componente genético materno, comprender por qué algunas pacientes no tienen HG en cada embarazo fue fundamental para desentrañar el mecanismo genético (la excepción confirma la regla). Entre los pacientes portadores de una rara mutación GDF15, el 18% de los embarazos no se vieron afectados por HG.
Se razonó que, dado que GDF15 causa náuseas/vómitos, la mutación debe causar sobreexpresión/actividad. Por lo tanto, se planteó la hipótesis de que los pacientes cuyo feto heredó la mutación de sus madres tenían un mayor riesgo de HG, mientras que los pacientes que heredaron la variante de tipo normal podrían estar protegidos. Sorprendentemente, se observó lo contrario.
En todos los embarazos en los que el feto heredó GDF15 de tipo salvaje (normal), la madre tenía HG y, por el contrario, cuando el feto heredó la mutación, la madre tenía menos probabilidades de verse afectada por la afección.
Aunque se trata de un tamaño de muestra pequeño, esto proporcionó la primera evidencia de la interacción entre los genes maternos y fetales en el riesgo de HG y la primera explicación biológica de por qué la HG puede ocurrir en un embarazo pero no en el siguiente (Figura 2).
Sin embargo, los resultados proporcionaron una paradoja, ya que sugirieron que la misma mutación que aumentaba el riesgo de HG en la madre reducía ese riesgo cuando la heredaba el feto.
La solución comenzó a desarrollarse en un experimento que demostró que la mutación no resultó en un aumento en los niveles/actividad de GDF15 sino que, por el contrario, fue un efecto knockout, lo que resultó en aproximadamente la mitad de los niveles normales de GDF15 que circulan en personas sanas no embarazadas que eran heterocigotas. portadores de la mutación.
Además, dos variantes adicionales en GDF15 asociadas con HG siguieron el mismo patrón de asociación con niveles circulantes más bajos en personas no embarazadas.
Un papel para la desensibilización
Para comprender cómo los niveles más bajos de una hormona de náuseas y vómitos pueden causar HG, se planteó la hipótesis de que las pacientes con HG, genéticamente predispuestas a niveles circulantes más bajos de GDF15 antes del embarazo, son hipersensibles al rápido aumento de los niveles de GDF15 durante el embarazo.
Tanto un modelo murino como la observación en humanos respaldaron el papel de la desensibilización . Los ratones fueron insensibilizados a los efectos aversivos de GDF15 mediante la administración de dosis bajas de GDF15 antes de una dosis alta.
En humanos, las condiciones y sustancias asociadas con altos niveles de GDF15 circulante antes del embarazo habían reducido el riesgo de HG durante el embarazo.
El descubrimiento de una función de la desensibilización sugiere que puede haber una manera de prevenir la HG.
Implicaciones clínicas.
Los nuevos hallazgos de que las náuseas y los vómitos son más graves cuando las pacientes tienen niveles más bajos de GDF15 antes del embarazo y niveles más altos durante el embarazo sugieren un camino hacia la prevención y el tratamiento (Figura 3).
Las pacientes con riesgo de HG pueden prepararse elevando los niveles de GDF15 antes del embarazo para disminuir su sensibilidad al GDF15 durante el embarazo. Un enfoque sería utilizar metformina, un fármaco conocido por aumentar los niveles circulantes de GDF15 que se ha utilizado para mejorar la fertilidad en pacientes con síndrome de ovario poliquístico.
Además, durante el embarazo, la reducción de los niveles de GDF15, como presumiblemente fue el resultado en pacientes cuyos fetos heredaron la mutación reductora de GDF15, puede reducir significativamente los síntomas de HG.
Los pacientes portadores de la mutación knockout para GDF15 eran fértiles y tenían embarazos/bebés sanos cuando el feto heredó la mutación, presumiblemente reduciendo GDF15 a la mitad . Estos ejemplos humanos vividos sugieren que la reducción de GDF15 puede ser segura.
Esta observación se ve respaldada por la reciente identificación y caracterización de knockouts de GDF15 homocigotos humanos, que revelan que los humanos que carecen por completo de GDF15 pueden exceder la esperanza de vida promedio y son fértiles, sin evidencia de una mayor prevalencia de enfermedades o disfunción metabólica.
Además, un grupo heterocigoto knockout para GDF15 en el estudio que tuvo tres hijos (dos que eran homocigotos knockout) no informó náuseas ni vómitos en ningún embarazo, lo que respalda que el bloqueo de GDF15 puede prevenir la HG (y la NVP).
Sin embargo, hay pruebas de que hay que hacer una pausa. En un estudio sobre abortos espontáneos, los niveles de GDF15 en las semanas 7 a 13 predijeron la pérdida fetal, con un tercio de los niveles en la cohorte de abortos espontáneos (aunque esta observación es probablemente consecuencia de una placentación anormal).
Además, GDF15 alcanza su punto máximo entre las semanas 33 y 35 de gestación, un momento en el que la mayoría de los embarazos no se ven afectados por NVP .
Entonces, ¿cuál es su papel en este momento? Alguna evidencia sugiere que, además de la NVP, el GDF15 puede ser un inhibidor de las células T, protegiendo la unidad fetal/placentaria en rápido crecimiento del ataque inmunológico materno (aunque es difícil conciliar esto con la falta de un receptor local y la falta de niveles alterados de GDF15).
Por lo tanto, hasta que tengamos una mejor comprensión, la reducción moderada de GDF15 o el bloqueo del receptor GFRAL restringido al tronco del encéfalo pueden presentar menos riesgos. De hecho, la empresa NGM Bio anunció sus planes de iniciar un estudio de prueba de concepto de fase 2 de su inhibidor de GFRAL NGM120 para el tratamiento de HG a finales de 2024.
GDF15 fuera del embarazo
Además de su papel en el embarazo, GDF15 puede ser una hormona que evolucionó para alertar a animales/personas no preñadas de que tienen más probabilidades de sobrevivir en un estado debilitado si descansan y se recuperan en lugar de buscar alimento.
El apoyo a esta teoría proviene de estudios de los niveles circulantes de GDF15, que muestran que está regulado positivamente en numerosos estados patológicos y en respuesta a múltiples factores estresantes ambientales, incluido el cáncer; enfermedades cardiovasculares, renales, mitocondriales, hepáticas y pulmonares; talasemia; infección; desnutrición; sobrenutrición; ejercicio excesivo; hipoxia; y toxinas ambientales que incluyen quimioterapia citotóxica, tabaquismo, falta de potasio e hipertiroidismo.
Cabe destacar la desnutrición; deficiencia de potasio; estrés cardíaco, renal y hepático; Infección por Helicobacter pylori; y el hipertiroidismo están asociados con embarazos con HG y pueden explicar, en parte, los niveles más altos de GDF15 observados en pacientes con HG .
NVP en el reino animal: el vínculo genético entre animales placentarios y no placentarios altera la teoría evolutiva
Se plantea la hipótesis de que la NVP es una adaptación evolutiva para proteger al feto de teratógenos durante la organogénesis . Esto está respaldado por evidencia pasada por alto de náuseas gestacionales en el reino animal.
Estudios realizados en la década de 1970 demostraron que los monos pueden experimentar NVP y alteraciones del apetito al principio del embarazo.
Además, los perros pueden tener anorexia temprana y vómitos que pueden ser lo suficientemente graves como para requerir la interrupción del embarazo. Los consejos veterinarios para gatas preñadas advierten que la falta temprana de apetito es común, y si la gata deja de comer durante más de 1 a 2 días, consulte al veterinario.
Sin embargo, los teratógenos ingeridos por la madre no pueden explicar completamente la afección, ya que también hay informes de falta de apetito en animales no placentarios, incluidos pájaros y reptiles. Después de la puesta de huevos, las gallinas pueden negarse a comer y permanecer en su gallinero. Un estudio sobre serpientes reveló que las víboras aspic dejan de cazar durante la gestación, y el 12% rechazó un ratón colocado directamente frente a ellas.
El comportamiento maternal más extremo se observa en el pulpo, donde la madre cuida sus huevos sin alimentarlos hasta la muerte.
Estos ejemplos sugieren que la pérdida gestacional del apetito es un comportamiento biológico que ha evolucionado y está codificado por genes, por lo que en algunas especies, el beneficio de una inanición total hasta la muerte supera el riesgo de un entorno hostil.
Hasta los tiempos modernos, encontrar alimentos no era un viaje rápido al mercado, sino que estaba plagado de riesgos, no sólo por la ingestión de alimentos teratogénicos sino también por depredadores, patógenos y otros riesgos ambientales, como el clima extremo.
Los genes que codifican un comportamiento que resulta en evitar esos riesgos en lugar de las necesidades nutricionales probablemente proporcionen alguna ventaja de supervivencia, que tal vez ya no exista para el embarazo humano moderno.
El apoyo a esto proviene de las observaciones de que aproximadamente el 30% de los embarazos no se ven afectados por la NVP y, recientemente, se han identificado knockouts humanos de GDF15 que son viables y fértiles.
Curiosamente, IGFBP7, el segundo mayor factor de riesgo genético asociado con HG en el estudio GWAS, es el homólogo humano del gen del factor de desgaste de la proteína de morfogénesis imaginal tardía 2 (IMPL2), que ha sido implicado tanto en la diapausa (latencia) en respuesta a estrés ambiental (es decir, temperaturas frías) en Drosophila y en la espiral de muerte materna del pulpo.
Este hallazgo que vincula biológicamente el comportamiento entre especies placentarias y no placentarias sugiere que se requiere una modificación de las teorías evolutivas.
Obviamente, lo que la madre consume después de poner huevos no puede tener un efecto teratogénico en la descendencia, por lo que la condición no puede haber evolucionado únicamente para evitar los teratógenos durante la organogénesis, desacreditando la explicación más comúnmente aceptada como el único fundamento de la NVP.
Observaciones finales
La HG aumenta el riesgo de múltiples resultados adversos para la madre y la descendencia y, por lo tanto, existe un beneficio en prevenir y/o tratar eficazmente la HG de forma segura para mejorar los síntomas y la ingesta nutricional.
Ahora contamos con pruebas biológicas sólidas que respaldan el papel causal del GDF15 y un camino para el desarrollo de nuevos métodos de prevención y tratamiento. Incluso antes de que estos tratamientos entren en la práctica clínica, es importante que los pacientes sepan que ha habido avances en la comprensión de su afección.
Finalmente, NVP y HG, probablemente todavía ventajosos en la naturaleza, probablemente sean mecanismos evolutivos anticuados para los humanos.
Las investigaciones futuras deberían centrarse en (i) mejorar la ingesta nutricional de los pacientes con HG y comprender el papel de los nutrientes en los resultados adversos, (ii) desarrollar y probar terapias para la prevención y el tratamiento basadas en los nuevos hallazgos, (iii) comprender el mecanismo de desensibilización del GDF15 y si la hormona tiene un papel secundario en el embarazo, (iv) determinar la generalización de los hallazgos genéticos en poblaciones adicionales, y (v) identificar y dilucidar el papel de genes de riesgo adicionales. Si bien quedan preguntas pendientes (ver Preguntas pendientes), es hora de allanar el camino para los ensayos clínicos y, con suerte, si son seguros y eficaces, limitar o tal vez incluso erradicar la HG.
El rincón del clínico
Para las náuseas y los vómitos del embarazo (NVP), las directrices del Colegio Americano de Obstetras y Ginecólogos recomiendan reemplazar las vitaminas prenatales con ácido fólico, pero la forma más grave de NVP, la hiperemesis gravídica (HG), se asocia con un mayor riesgo de efectos adversos maternos, fetales, y los resultados de los niños, algunos de los cuales se sabe que están asociados con deficiencias nutricionales graves.
Es probable que la suplementación con ácido fólico sea inadecuada. La suplementación con tiamina puede prevenir la encefalopatía de Wernicke.
Los genes que codifican proteínas reguladas positivamente durante la espiral de muerte materna en el pulpo [IGFBP7 (IMPL2)] y una hormona implicada en la pérdida de apetito en la caquexia y las náuseas de la quimioterapia (GDF15) están asociados con el riesgo de NVP y HG.
La condición probablemente resultó en una ventaja evolutiva en algunas especies que ya no es necesaria en los humanos.
La hormona GDF15 producida por el feto/placenta es la causa principal de NVP y HG. Circula en niveles más altos en personas con HG, pero existe cierta superposición y la sensibilidad al GDF15 también influye.
La gravedad de la NVP está determinada por la sensibilidad de la mujer al GDF15, que puede estar determinada por sus genes. Las mujeres que tienen niveles más bajos de GDF15 antes del embarazo son más sensibles al aumento de GDF15 durante el embarazo.
Los métodos para elevar los niveles circulantes de GDF15 antes del embarazo (como la metformina) pueden disminuir el riesgo de HG durante el embarazo.
Si es seguro, bloquear la señalización de GDF15 durante el embarazo puede conducir a tratamientos más eficaces para aliviar los síntomas.
Preguntas pendientes
¿Qué deficiencias de nutrientes (incluidos el ácido fólico, la vitamina B1 y la vitamina K) contribuyen al mayor riesgo de resultados maternos, fetales e infantiles adversos asociados con la HG, y cómo podemos crear y/o implementar pautas para mejorar la ingesta?
¿Por qué hay niveles tan altos de GDF15 circulante durante el embarazo, particularmente en el tercer trimestre cuando la NVP del embarazo generalmente se limita al primer trimestre, y cómo funciona la desensibilización?
¿El aumento de GDF15 antes del embarazo reducirá el riesgo de HG durante el embarazo? Si es así, ¿cuánto necesitamos aumentarlo y durante cuánto tiempo? ¿Será seguro para la madre y el bebé?
¿La reducción de la señalización de GDF15 durante el embarazo disminuirá los síntomas de NVP durante el embarazo y, de ser así, qué tan baja debe ser para que tenga una importancia clínica significativa y será segura para la madre y el bebé?
¿Qué otros genes/mecanismos están asociados con la etiología de HG en distintas poblaciones (es decir, cuál es el papel de IGFBP7, que también está genéticamente asociado con HG)?

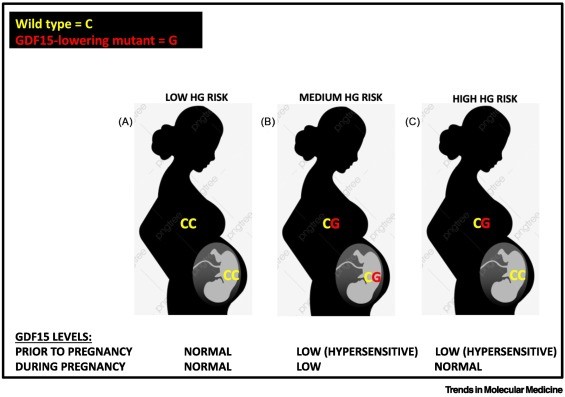
La gravedad de las náuseas y los vómitos durante el embarazo depende de una combinación de (i) los niveles de GDF15 de la madre antes del embarazo (determinados por la genética pero también por factores ambientales como fumar tabaco o tomar metformina y/o ciertas condiciones/enfermedades como la β-talasemia) y (ii) la niveles producidos durante el embarazo por el feto/placenta (es decir, determinados por genes fetales, sexo fetal y múltiples).
(A–C) Una mutación reductora de GDF15 (G) en la madre aumenta la sensibilidad al aumento de GDF15 durante el embarazo debido a niveles más bajos antes del embarazo, pero la misma mutación disminuye los síntomas durante el embarazo si el feto la hereda debido a niveles más bajos de GDF15. durante el embarazo.
Además de los factores previos al embarazo, otros factores asociados con los niveles circulantes de GDF15 durante el embarazo también pueden alterar el riesgo.

Los factores asociados con el aumento de los niveles circulantes de la hormona GDF15 para las náuseas y los vómitos cuando no se está embarazada se asocian con un menor riesgo de hiperemesis gravídica (HG).
Por el contrario, las variantes genéticas de GDF15 asociadas con un GDF15 circulante más bajo cuando no se está embarazada se asocian con un mayor riesgo de HG.
Durante el embarazo, las pacientes con HG tienen niveles elevados de GDF15. Las intervenciones terapéuticas pueden consistir en aumentar los niveles de GDF15 o la señalización antes del embarazo para desensibilizar a las personas al GDF15 y disminuir el riesgo de HG. Durante el embarazo, reducir los niveles o la señalización de GDF15 puede disminuir el riesgo de HG.