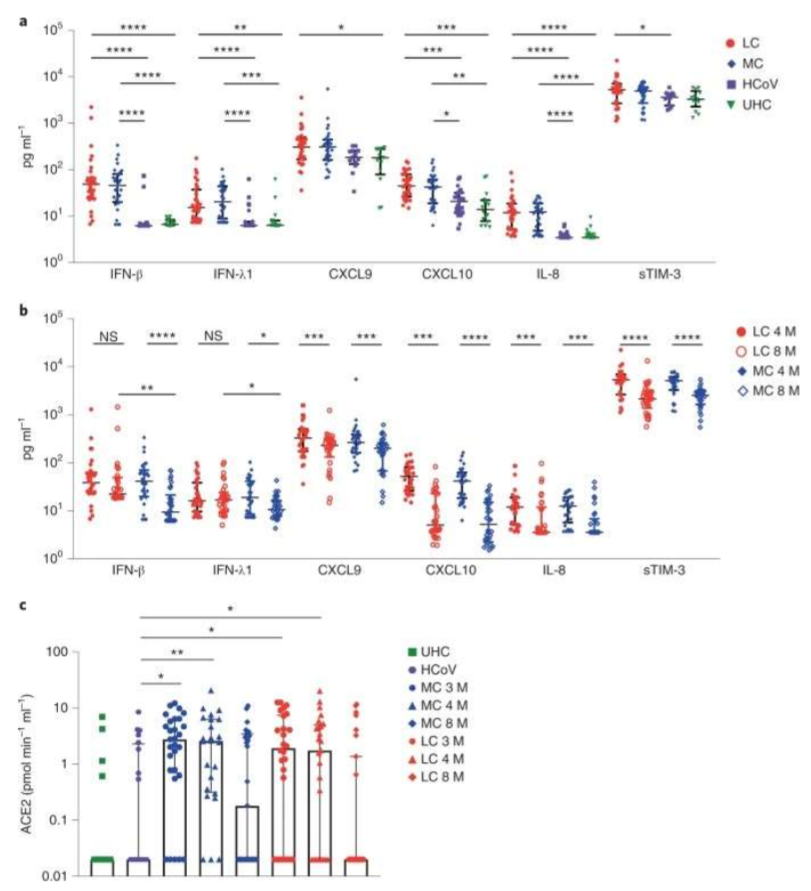
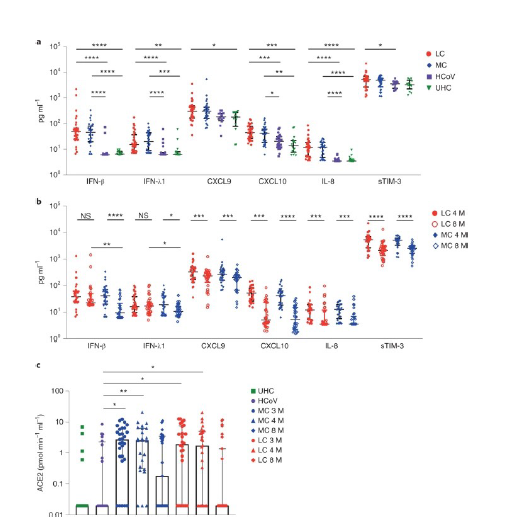
La disfunción inmunológica persiste en algunas personas durante 8 meses después de la infección inicial por SARS-CoV-2.
La Covid-19 aguda, causada por la infección por el por el virus SARS-CoV-2 o sus variantes, se caracteriza por un amplio espectro de gravedad clínica, desde asintomática hasta fatal. La respuesta inmunitaria durante la enfermedad aguda contribuye tanto a la defensa del huésped como a la patogenia de la Covid-19 grave . En la fase aguda se ha descrito una desregulación inmune pronunciada con linfopenia y aumento de la expresión de mediadores inflamatorios. Después de la infección aguda por Covid-19, una proporción de pacientes desarrollan síntomas físicos y neuropsiquiátricos que duran más de 12 semanas (conocidos como COVID prolongado, síndrome crónico de Covid o secuelas post-agudas de Covid-19), en lo sucesivo denominados LC .
LC a menudo se desarrolla después de una Covid-19 leve a moderada . Los síntomas que persistieron durante 6 meses se observaron en el 76% de los pacientes hospitalizados, siendo la debilidad muscular y la fatiga las más frecuentes. La LC afecta entre el 10 % y el 30 % de los casos de Covid-19 de gestión comunitaria de 2 a 3 meses después de la infección y puede persistir >8 meses después de la infección. Los síntomas de LC incluyen fatiga severa recurrente, disnea, opresión en el pecho, tos, confusión mental y dolor de cabeza. La fisiopatología subyacente de LC no se conocía hasta el excelente trabajo de Phetsouphanh ,et.al.,recientemente publicado en Nature Immunology (2022) https://doi.org/10.1038/s41590-021-01113-x.
=> Recibir por Whatsapp las noticias destacadas
En su investigación Phetsouphanh ,et.al. ,estudiaron una cohorte de individuos seguidos sistemáticamente durante 8 meses después de la infección por Covid-19 de acuerdo con un programa predefinido, comparándolos con donantes sanos no expuestos al SARS-CoV-2 (controles sanos no expuestos [UHC]) antes de diciembre de 2019, e individuos que habían sido infectados con coronavirus humanos prevalentes (HCoV; HCoV-NL63, O229E, OC43 o HKU1), pero no con SARS-CoV-2. El estudio ADAPT9 inscribió a adultos con infecciones por SARS-CoV-2 confirmadas por PCR en las clínicas de pruebas comunitarias del Hospital St Vincent en Sydney (Australia). Para la mayoría de los participantes, su primera visita ocurrió entre los meses 2 y 3 después de la infección; el 93,6 % y el 84,5 % de los participantes completaron el mes 4 subsiguiente (mediana, 128 días) ) y visitas del mes 8 (mediana, 232 días), respectivamente.
De los 147 pacientes reclutados (70,5 % a través de sitios ADAPT y 29,5 % de forma externa), 31 participantes (21,08 %) fueron designados como LC en función de la aparición de uno de los tres síntomas principales (fatiga, disnea o dolor torácico) 4 meses o más después de la fase aguda de la enfermedad . Estos participantes fueron emparejados por edad y género con 31 controles emparejados (MC) asintomáticos de la misma cohorte que no informaron síntomas en el mes 4 después de la infección pero que fueron sintomáticos durante la fase aguda de la infección(MC). Hubo una tendencia del 10 % hacia alguna mejora de los síntomas con el tiempo en LC, pero esta tendencia no fue estadísticamente significativa (P exacta de Fisher = 0,44).
Con el objetivo de determinar biomarcadores asociados con LC, los investigadores analizaron 28 analitos en el suero de pacientes de los grupos LC, MC, HCoV y UHC en el mes 4 a 8 después de la infección (Figura 1).
Debido a que se informó que la actividad plasmática de ACE2(receptor del SARSCoV-2) es elevada 114 días después de la infección por SARS-CoV-2,los investigadores estudiaron si esto ocurrió en su cohorte en los meses 3, 4 y 8 después de la infección. La mediana de la actividad plasmática de ACE2 fue significativamente mayor en los grupos LC y MC en comparación con el grupo HCoV en el mes 3 (LC, 1,92 veces; MC, 2,47 veces) y el mes 4 (LC, 1,75 veces; MC, 2,62 veces) después de la infección(Figura 1) . En el mes 8, la actividad plasmática de ACE2 en los grupos LC y MC disminuyó a los niveles observados en los grupos HCoV y UHC . No se observaron diferencias dentro de los grupos LC y MC en los meses 3, 4 u 8, pero ambos grupos tuvieron una mayor actividad en comparación con el grupo HCoV, lo que sugiere que este parámetro es específico de la infección por SARS-CoV-2 y no es una característica común de otros coronavirus.
Luego, los investigadores usaron un modelo de clasificación para determinar un conjunto óptimo de analitos más fuertemente asociados con LC. Este clasificador lineal se entrenó en datos de analitos transformados logarítmicamente para reducir el sesgo observado en cada uno de los analitos y mejorar la precisión del modelo.
Este modelo de clasificación logarítmico-lineal se utilizó para desarrollar una métrica para la importancia de las características. Para identificar los analitos que se asociaron con LC y no con MC, utilizaron los datos de analitos en el mes 8, el punto temporal con la mayor diferencia entre los grupos de LC y MC( Figura 1). El rendimiento de cada uno de los modelos logarítmicos lineales se cuantificó mediante una estimación de precisión y se evaluó una puntuación F1 tomando promedios después del arranque, que tomó muestras aleatoriamente de la población original para crear una nueva población. Al considerar todos los pares posibles de los 28 analitos séricos y la actividad plasmática de ACE2, un modelo de clasificación que incluye dos analitos (IFN-β y pentraxina 3 (PTX3)) tuvo una precisión de pronóstico de LC del 78,54 % y una puntuación F1 de 0,77.
Tres analitos (IFN-β, PTX3 e IFN-γ) lograron una precisión del 79,68 %, con una puntuación F1 de 0,79. Cuatro analitos (IFN-β, PTX3, IFN-λ2/3 e IL-6) lograron una precisión del 81,59 % y una puntuación F1 de 0,81.
Esto reveló que IFN-β era la característica más importante, apareciendo en el 89%, 93% y 94% de los mejores conjuntos de dos, tres y cuatro características, respectivamente .
Para investigar las diferencias en los perfiles de células inmunitarias entre LC y MC, los investigadores desarrollaron un panel de citometría de flujo de 19 parámetros y células mononucleares de sangre periférica (PBMC) fenotípicas de donantes de LC y MC en los meses 3 y 8 después de la infección.
Asi pues, resumiendo e interpretando los datos de Phetsouphanh y colaboradores que demuestran por primera vez que los perfiles inmunes convalecientes después de Covid-19 son diferentes de los que siguen a la infección con otros coronavirus.
Varias citocinas (principalmente IFN tipo I y III, pero también quimiocinas que actúan subsecuente a IFN-γ) estaban muy elevadas en individuos después de la resolución de la infección activa por SARS-CoV-2 en comparación con HCoV y UHC en el mes 4 después de la infección. IFN-β e IFN-λ1 permanecieron elevados en el grupo LC en el mes 8 después de la infección inicial, mientras que sus niveles comenzaron a resolverse en MC. Se observó una actividad plasmática elevada de ACE2 en los grupos LC y MC en el mes 4, pero tendió a normalizarse en el mes 8 después de la infección. Los investigadores identificaron un conjunto de analitos (IFN-β, PTX3, IFN-γ, IFN-λ2/3 e IL-6) que se asociaron altamente con LC en el mes 8, lo que indica que los componentes de la respuesta inflamatoria aguda y la activación de fibroblastos o células epiteliales , los linfocitos T y las células mieloides están asociadas con LC.
El fenotipado de células inmunitarias indicó la activación crónica de un subconjunto de linfocitos T CD8+, con expansión de los subconjuntos PD-1+ y TIM-3+ y pDC y monocitos que persistieron del mes 3 al mes 8 en el grupo LC. Estos cambios estuvieron acompañados por una ausencia de subconjuntos de linfocitos T y B vírgenes que expresan niveles bajos de CD127 y TIM-3 en sangre periférica de pacientes con LC. Estos hallazgos sugieren que la infección por SARS-CoV-2 ejerce efectos residuales prolongados únicos en los sistemas inmunitarios innato y adaptativo y que esto puede estar impulsando la sintomatología conocida como LC.
IFN-β e IFN-λ1 estaban muy elevados en muestras convalecientes de Covid-19 en comparación con muestras de HCoV y UHC. Aunque estos niveles disminuyeron con el tiempo en pacientes que se recuperaron, permanecieron altos en pacientes con LC. La morbilidad de la infección aguda por Covid-19 parece correlacionarse con una alta expresión de IFN tipo I y III en los pulmones de los pacientes. El IFN-λ producido por las células dendríticas de pulmón murino en respuesta al ARN viral sintético se asocia con daño al epitelio pulmonar, y la actividad de IFN-λ dificulta la reparación pulmonar durante la infección por influenza .
La Covid-19 aguda grave se ha asociado con una disminución del IFN tipo I y una mayor respuesta de la IL-6 y el factor de necrosis tumoral (TNF). Aunque la cohorte de individuos con LC estudiada por Phetsouphanh y colaboradores consistía principalmente en pacientes con enfermedad inicial leve o moderada, los niveles elevados de IFN tipo I y III se mantuvieron hasta el mes 8 después de la infección y son consistentes con la activación prolongada observada de pDC, lo que indica una respuesta inflamatoria crónica.
Los pacientes con Covid-19 que ingresan en la unidad de cuidados intensivos tienen niveles plasmáticos elevados de sTIM-3 . Los investigadores encontraron niveles elevados de sTIM-3 en el grupo LC, pero no en los grupos MC o HCoV, lo que es consistente con los subconjuntos ampliados de linfocitos T CD8+ de memoria que expresan TIM-3 y PD-1 e indica activación crónica de linfocitos T y potencialmente agotamiento funcional. De manera similar, la eliminación de la proteína ACE-2 unida a la membrana durante la infección aguda, lo que resulta en una mayor actividad en el plasma, continúa hasta la convalecencia, independientemente de la gravedad de los síntomas en el mes 4, y se normaliza en el mes 8 en la mayoría de los pacientes.
IFN-β, junto con PTX3, IFN-λ2/3, IFN-γ e IL-6, diferenciaron LC de MC con alta precisión en el mes 8. IFN-λ2/3 son secretados por pDC luego de la detección de ARN viral por TLR7, TLR9 y RIG-1.
PTX3 aumentó en el epitelio pulmonar y el plasma de pacientes con COVID-19 grave y puede servir como un fuerte indicador pronóstico independiente de mortalidad a corto plazo.
La IL-6 es un mediador pleiotrópico que impulsa la inflamación y la activación inmunitaria. Una proporción alta de IL-6/IFN-γ se asocia con una infección aguda grave por COVID-19. La observación de que el mejor correlato para LC es una combinación ecléctica de biomarcadores refuerza la amplitud de las vías de respuesta del huésped que se activan durante LC.
La activación de los linfocitos T (indicada por CD38 y HLA-DR), el agotamiento funcional de los linfocitos T y el aumento de los plasmablastos de las células B ocurren durante la COVID-19 grave . Estos marcadores identificaron monocitos y pDC altamente activados, cuyas frecuencias disminuyeron con el tiempo en MC, pero no en pacientes con LC. Los IFN tipo I y tipo III aumentan la expresión del complejo principal de histocompatibilidad, incluido HLA-DR33.
Un enfoque imparcial de reducción dimensional a gran escala identificó el agotamiento de tres grupos de subconjuntos de linfocitos B y T vírgenes presentes en el grupo LC en el mes 8 después de la infección. En conjunto, estas observaciones sugieren una conversión persistente de linfocitos T vírgenes(sin experiencia contra antígenos) en estados activados, posiblemente debido a la activación de espectador secundaria a la inflamación subyacente y/o la presentación de antígenos por pDC o monocitos activados. El resultado final de esta estimulación crónica puede ser la expansión de los linfocitos T de memoria PD-1+ o TIM-3+ CD8+.
Aunque los individuos con LC y MC se emparejaron por edad y género, es posible que las diferencias observadas reflejen diferencias en factores no reconocidos entre estos grupos. Aunque algunas perturbaciones observadas son potencialmente consistentes con la hipótesis de que los principales impulsores de la expresión de biomarcadores en la convalecencia son los de la infección aguda, otros no lo son. Como todo en ciencia,los muy interesantes resultados de este excelente trabajo sobre LC descritos por Phetsouphanh y colegas deberán ser replicados en otros estudios independientes para solidificar su importancia .
Debido al momento de la aprobación ética y la configuración de la cohorte estudiada por Phetsouphanh y colegas, no se recolectaron muestras durante la infección aguda. Por lo tanto, no se pudo determinar si las elevaciones de los biomarcadores durante la convalecencia se correlacionan con los niveles durante la infección aguda, y los resultados requieren validación en otras cohortes de LC. Finalmente, la definición de LC utilizada por Phetsouphanh y colegas se estableció internamente dada la falta de consenso internacional. Sin embargo, la inclusión de tres de los síntomas persistentes más comunes y el cegamiento de casos y controles ayudaron a asegurar la validez de sus hallazgos.
En resumen, los resultados encontrados y estudiados durante 8 meses de seguimiento de pacientes con LC por primera vez, indican una respuesta inflamatoria continua y sostenida incluso después de una Covid-19 aguda de leve a moderada, que no se encuentra después de una infección prevalente por coronavirus. Los impulsores de esta activación requieren más investigación, pero las posibilidades incluyen la persistencia del antígeno, la autoinmunidad impulsada por la reactividad cruzada antigénica o un reflejo de la reparación del daño.
Estas observaciones describen un perfil inmunológico anormal en pacientes con Covid-19 en puntos de tiempo prolongados después de la infección y brindan una base sólida sobre la existencia del síndrome de LC. Los importantes hallazgos reportados por Phetsouphanh y colaboradores proporcionan una base importante para comprender la fisiopatología del síndrome de Covid-19 prolongado (LC) y las posibles vías terapéuticas para su manejo y tratamiento.
Ahora la pregunta clave es porqué de los pacientes con Covid-19 agudo, solo una proporción de ellos evoluciona a padecer síndrome de Covid-19 prolongado. Mi hipótesis favorita es que es debido al patrón único de genes de respuesta inmune expresados en cada individuo y otros factores que dictan la diversidad de la respuesta inmune, ampliamente elaborada en una publicación anterior (https://eju.tv/2021/12/la-diversidad-de-la-respuesta-inmunologica/).
Fig. 1: Niveles elevados de citoquinas proinflamatorias que persisten más de 8 meses después de la convalecencia.
a, Niveles más altos de IFN-β, IFN-λ1, CXCL9, CXCL10, IL-8 y sTIM-3 a los 4 meses en el grupo LC (n = 31) y MC (n = 31) en comparación con los individuos infectados con resfriado común coronavirus (HCoV) (n = 25) y donantes sanos no expuestos (n = 13). b, Reducción de los niveles de citoquinas a los 8 meses. Los niveles de IFN-β e IFN-λ1 fueron más altos en el grupo LC que en el grupo MC en el mes 8. c, la actividad de ACE2 aumentó en los meses 3 y 4 después de la infección por SARS-CoV-2 y luego disminuyó a los 8 meses en ambos grupos. La actividad de ACE2 en los grupos de HCoV y de donantes sanos no expuestos (UHC) fue mínima. Los datos se muestran como medianas con barras de error que representan rangos intercuartílicos (IQR). Se utilizó la corrección de Kruskal-Wallis con Dunn para el análisis de 4 meses; Los valores de P de dos colas <0,05 (*), <0,01 (**), <0,001 (***) y <0,0001 (****) se consideraron significativos. Se usó una prueba t de Wilcoxon para la comparación pareada de datos de 4 y 8 meses, y una prueba t de Mann-Whitney para muestras no pareadas. HCoV, infectado por coronavirus endémico humano; M, meses; NS, no significativo.
Ronald Palacios Castrillo, M.D.,PhD.