Ronald Palacios Castrillo, M.D.,PhD.
La diabetes mellitus tipo 1 es una enfermedad metabólica crónica resultante de la destrucción autoinmune de las células beta pancreáticas. Más de la mitad de los casos de diabetes tipo 1 se diagnostican en la edad adulta; El 62 % de los casos nuevos en 2021 se diagnosticaron en pacientes mayores de 20 años.1. Existen diferencias genéticas, inmunitarias y metabólicas clave entre la diabetes tipo 1 de inicio en la infancia y la edad adulta.2. Como resultado de una edad más avanzada en diagnóstico y una esperanza de vida más larga, la edad media de una persona que vive con diabetes tipo 1 es ahora de 40 años.1.
Alcance del problema
A pesar de los notables avances en la atención de la diabetes, los pacientes con diabetes tipo 1 siguen teniendo una esperanza de vida aproximadamente 13 años más corta que la de la población general.3. Las enfermedades cardiovasculares son la causa principal de esta esperanza de vida más corta y, a lo largo de su vida, las personas con diabetes tipo 1 tienen un mayor riesgo de enfermedad cardiovascular que la población general(4-12). En el Estudio de control y complicaciones de la diabetes (DCCT) y en el estudio de seguimiento Epidemiología de las intervenciones y complicaciones de la diabetes (EDIC), la enfermedad cardiovascular fue la principal causa de muerte, y los participantes asignados aleatoriamente a una meta de hemoglobina glucosilada del 9% (75 mmol por mol), la meta convencional, tenían un mayor riesgo de muerte por causas cardiovasculares a los 20 años que aquellos asignados aleatoriamente a la meta más estricta de 7 % (53 mmol por mol).13. De manera similar, un análisis de los datos del Registro Nacional Sueco de Diabetes reveló la estrecha asociación entre los niveles de hemoglobina glucosilada y el riesgo de muerte por causas cardiovasculares. En particular, en un estudio de 2014 que utilizó datos del Registro Nacional Sueco de Diabetes, incluso los pacientes con un nivel de hemoglobina glucosilada del 6,9 % (52 mmol por mol) o menos tenían un riesgo de muerte por causas cardiovasculares que era mayor en un factor de 2 que el de los controles no diabéticos.14. Una revisión sistemática y un metanálisis de datos de más de 214.000 pacientes con diabetes tipo 1 mostraron que el riesgo relativo de eventos cardiovasculares era dos veces mayor para las mujeres que para los hombres.15.
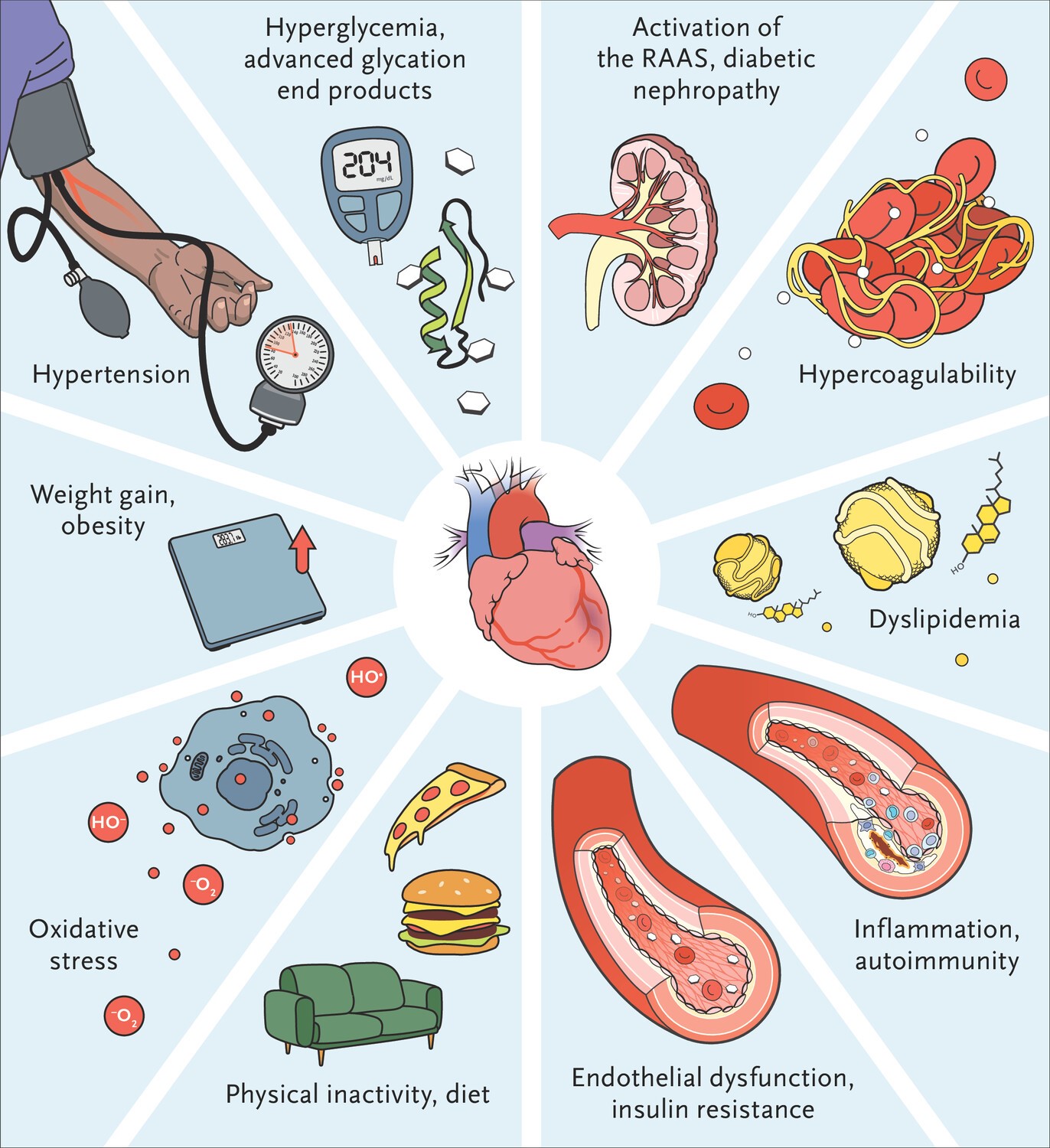
Figura. Fisiopatología de enfermedades cardiovasculares en pacientes con Diabetes Mellitus tipo 1 Autoinmune.
Biología de la enfermedad cardiovascular en la diabetes tipo 1
Los mecanismos implicados en el desarrollo de enfermedades cardiovasculares en personas con diabetes tipo 1 son similares a los que se han identificado en personas con diabetes tipo 2 .16. Sin embargo, en un estudio que utilizó tomografía computarizada multicorte para evaluar la carga de placa en 135 pacientes asintomáticos con diabetes tipo 1 o 2, la enfermedad coronaria obstructiva fue menos extensa en personas con diabetes tipo 1 que en aquellas con diabetes tipo 1 (2), incluso cuando los pacientes fueron emparejados en cuanto a puntuaciones de calcio en las arterias coronarias.17. Además, un hallazgo potencialmente protector en la cohorte con diabetes tipo 1 fue un menor número de placas no calcificadas. Un estudio reciente de casos y controles demostró que la incidencia de inflamación de la pared vascular era mayor entre pacientes con diabetes tipo 1 que entre personas sin diabetes emparejadas por edad, sexo e índice de masa corporal (IMC), un efecto que era independiente del control glucémico. Este hallazgo se asoció con un aumento de los marcadores inflamatorios circulantes.18. La confirmación de estos resultados en estudios futuros resultará útil para comprender las diferencias en la fisiopatología y el tratamiento de la aterosclerosis entre pacientes con diabetes tipo 1 y aquellos con diabetes tipo 2.
Aunque la resistencia a la insulina, que se agrupa con varios factores de riesgo cardiovascular, es una característica distintiva de la diabetes tipo 2(19), su presencia en pacientes con diabetes tipo 1 también se asocia con disfunción cardiovascular(20,21), una asociación que es independiente de la glucemia.22. El examen de los datos del Estudio de Epidemiología de las Complicaciones de la Diabetes de Pittsburgh reveló que la presencia del síndrome metabólico y algunos de sus componentes individuales en pacientes con diabetes tipo 1 se asociaba con peores resultados cardiovasculares y renales.23.
Enfermedad renal diabética
La albuminuria, una tasa de filtración glomerular reducida, o ambas, se asocian con un mayor riesgo de eventos cardiovasculares y muerte(24,25). El antagonismo del sistema renina-angiotensina-aldosterona, además del control estricto de la glucemia, es la estrategia utilizada mejor establecida. para retrasar la progresión de la enfermedad renal diabética. En un ensayo, captopril ralentizó la progresión de la enfermedad renal en pacientes con diabetes tipo 1 y nefropatía sin afectar el riesgo de muerte por causas cardiovasculares.26. Sin embargo, el tratamiento con captopril se asoció con una reducción del 50% en el riesgo compuesto de muerte , diálisis y trasplante renal. El estudio más reciente Heart Outcomes Prevention Assessment (HOPE), en el que participaron 3.577 pacientes con diabetes, 81 de los cuales tenían diabetes tipo 1, demostró que el ramipril reducía la incidencia de eventos cardiovasculares y nefropatía manifiesta.27. Ensayos clínicos que examinan el efecto de medicamentos similares al glucagón, El agonismo del receptor del péptido 1 (GLP-1) y el antagonismo del receptor de mineralocorticoides en pacientes con diabetes tipo 1 y enfermedad renal, que actualmente están en marcha, ofrecen esperanza para estrategias terapéuticas adicionales y un estudio para saber qué tan bien funciona el tratamiento del estudio Finerenone y qué tan seguro es en personas con disminución a largo plazo en la capacidad de los riñones para funcionar correctamente [enfermedad renal crónica] junto con diabetes tipo 1.
Reducir la carga de enfermedades cardiovasculares
Control Glicémico
Los niveles de hemoglobina glucosilada están estrechamente correlacionados con el riesgo de resultados cardiovasculares adversos y muerte entre personas con diabetes tipo 1(28). Los efectos independientes de la hiperglucemia son multifactoriales e incluyen la activación del sistema renina-angiotensina-aldosterona y las vías proinflamatorias, una mayor producción de reactivos especies de oxígeno y formación de productos finales de glicación avanzada y activación de sus receptores (16,29,30). La mayor parte de la evidencia que respalda la importancia del control estricto de la glucemia proviene de los estudios DCCT/EDIC, que demostraron que la terapia intensiva con insulina disminuyó la aparición de complicaciones microvasculares.31. Aunque la incidencia de eventos cardiovasculares no difirió significativamente entre las dos cohortes de estudio (pacientes asignados a terapia intensiva y aquellos asignados a la atención habitual) durante los 6,5 años iniciales de seguimiento (DCCT), posteriores .El seguimiento (EDIC) mostró una reducción del 42% en eventos cardiovasculares a los 17 años(32) y una reducción del 30% después de 30 años(33) en la cohorte de terapia intensiva, a pesar de niveles iniciales similares de hemoglobina glucosilada en los dos grupos. Estos efectos se han atribuido a un control glucémico más estricto en una etapa más temprana del curso de la enfermedad (“memoria metabólica”) y a una menor incidencia de enfermedad renal diabética(33). Además, el grupo de terapia intensiva tuvo una menor prevalencia de hipertensión.34. Dichos efectos, atribuidos a la memoria metabólica, han dado lugar a más investigaciones(34,35).
Tratamiento de la hipercolesterolemia
Faltan datos de ensayos controlados aleatorios que examinen el efecto de las estatinas sobre la enfermedad cardiovascular aterosclerótica en pacientes con diabetes tipo 1. Sin embargo, una de las líneas de evidencia más convincentes que respaldan el beneficio de las estatinas en la diabetes tipo 1 proviene del Registro Nacional Sueco de Diabetes. Un total de 24.230 pacientes con diabetes tipo 1 que no tenían antecedentes de enfermedad cardiovascular fueron seguidos para detectar el desarrollo de infarto agudo de miocardio, accidente cerebrovascular, enfermedad coronaria, muerte por causas cardiovasculares y muerte por cualquier causa.35. De estos participantes, 5.387 fueron tratados con terapia hipolipemiante (de los cuales el 97% recibió estatinas) y 18.843 no recibieron tratamiento. Después de un seguimiento medio de 6 años, los índices de riesgo en el grupo tratado con estatinas en comparación con el grupo no tratado fueron 0,56 (intervalo de confianza [IC] del 95%, 0,48 a 0,64) para muerte por cualquier causa, y 0,85 (IC del 95%, 0,74 a 0,97) para enfermedad coronaria fatal o no fatal.
Dada la falta de datos de alta calidad de ensayos controlados aleatorios, las guías publicadas por sociedades profesionales de cardiología, endocrinología y nefrología no han recomendado de manera consistente el uso de estatinas(36-40).
Dado el gran número de niños y adolescentes que tienen diabetes tipo 1, los médicos a menudo se enfrentan al desafío de considerar el uso de estatinas en esta población. En un estudio, los jóvenes con diabetes tipo 1 (edad media, 15 años) tenían niveles más altos de proproteína convertasa subtilisina-kexina tipo 9 (PCSK9), que se correlaciona positivamente con la hemoglobina glucosilada, los triglicéridos, el colesterol total y las lipoproteínas de baja densidad. LDL), que los controles de la misma edad.42. En otro estudio de jóvenes con diabetes tipo 1 (edad media ± DE, 13,9 ±3,0 años), el empeoramiento del control glucémico se asoció con un aumento de los niveles plasmáticos de PCSK9 y colesterol LDL.43. Estos hallazgos han llevado a un uso más agresivo de estatinas en jóvenes con diabetes tipo 1.44. La Sociedad Internacional de Diabetes Pediátrica y Adolescente y la Asociación Americana de Diabetes (ADA) difieren en sus recomendaciones para el uso de estatinas en niños con diabetes tipo 1 mayores de 10 años de edad. Aunque la Administración de Alimentos y Medicamentos (FDA) solicitó recientemente la eliminación de la etiqueta de “categoría X de embarazo” para las estatinas, no se recomienda el uso de estatinas en mujeres con diabetes tipo 1 que están embarazadas o amamantando.45. Ezetimiba, ácido bempedoico, y los inhibidores de PCSK9 también reducen los niveles de colesterol LDL pero no han demostrado eficacia en pacientes con diabetes tipo 1.
Control de la hipertensión y la presión arterial
La hipertensión es común en la diabetes tipo 1. Su presencia se ha correlacionado positivamente con la duración de la enfermedad y la edad de la población examinada. En el estudio European Diabetes Insulin-Dependent Diabetes Mellitus (EURODIAB IDDM), la prevalencia de hipertensión fue del 24% (edad media, 32,7 ± 10 años; duración media de la diabetes, 14,7 ± 9,3 años).46. Maahs et al. informaron una prevalencia aún mayor de presión arterial elevada (43%) entre una muestra de pacientes representativa de la población (edad media, 37 ± 9 años; duración media de la diabetes, 23,2 ± 8,9 años), y sólo el 42% de los pacientes tenían niveles adecuados de la presión arterial.47. Un estudio más reciente, en el que participaron 4.060 pacientes con diabetes tipo 1, mostró una prevalencia de hipertensión del 66,2%, a pesar de que, según se informó, más del 60% de los participantes utilizaban bloqueadores del sistema renina-angiotensina-aldosterona.48. Al igual que con las estatinas , la evidencia que guía los objetivos de presión arterial para pacientes con diabetes tipo 1 se originó a partir de estudios de pacientes con diabetes tipo 2 o adultos sin diabetes(49,50). Aunque un ensayo clínico que examina específicamente el papel del bloqueo del sistema renina-angiotensina-aldosterona en la prevención de la progresión de la enfermedad renal diabética en pacientes con diabetes tipo 1 se publicó hace 30 años, faltan datos más recientes.26. La ADA recomienda que las personas con diabetes y una medición de la presión arterial en el consultorio de 130/80 mm Hg o más deben recibir terapia farmacológica para reducir la presión arterial.36. Un análisis de 25 años de datos de 605 participantes con diabetes tipo 1 y sin enfermedad cardíaca conocida en el estudio de Epidemiología de las Complicaciones de la Diabetes (EDC) de Pittsburgh mostró que la presión arterial por encima del umbral de 120/80 mmHg predijo un mayor riesgo de enfermedad coronaria.51.
El tratamiento farmacológico debe incluir agentes de una clase de medicamentos con beneficios cardiovasculares comprobados en la diabetes: diuréticos tipo tiazida, bloqueadores de los canales de calcio dihidropiridina, inhibidores de la enzima convertidora de angiotensina (ECA) o bloqueadores de los receptores de angiotensina. Además, la ADA señaló que los pacientes con hipertensión y albuminuria se beneficiarían particularmente del bloqueo del sistema renina-angiotensina-aldosterona.49. Los médicos que consideren el uso de betabloqueantes en pacientes con diabetes tipo 1 que tienen enfermedad arterial coronaria establecida o insuficiencia cardíaca deben tener en cuenta el riesgo potencialmente mayor de hipoglucemia grave en esta población.52.
Manejo de la obesidad
La obesidad es una condición coexistente recientemente reconocida en personas con diabetes tipo 1. Un informe de T1D Exchange señaló que el índice de masa corporal (IMC, calculado como el peso en kilogramos dividido por el cuadrado de la altura en metros) de 22.697 pacientes con diabetes tipo 1 era similar al de los pacientes sin diabetes y también era similar en todos los grupos de edad (53,54). En general, la prevalencia de obesidad en la diabetes tipo 1 aumentó del 32,6 % en 2004 al 36,8 % en 2018.48. En el DCCT, la terapia intensiva con insulina se asoció con un aumento de peso corporal.55. Después de 6,5 años de terapia intensiva, el 19% de los pacientes tenía un IMC superior a 30, en comparación con el 6% de los pacientes que recibieron terapia convencional.56. Como era de esperar, el aumento excesivo de peso se asoció con características del síndrome metabólico y la resistencia a la insulina.57. Sorprendentemente, La incidencia de enfermedades cardiovasculares entre los pacientes del grupo de terapia intensiva que tuvieron el mayor aumento de peso fue similar a la incidencia entre los del grupo de terapia convencional.57.
La patogénesis de la obesidad en la diabetes tipo 1 es más compleja que una simple reducción de la glucosuria que conduce a un balance energético positivo. Los refrigerios conductuales para evitar la hipoglucemia son comunes entre los pacientes, particularmente aquellos con diabetes de larga data, dadas las imperfecciones de las formulaciones de insulina más antiguas. La disfunción y la fibrosis del tejido adiposo, los cambios en el microbioma, la disfunción de las células beta, la disfunción mitocondrial y los efectos metabólicos diferenciales de la insulina en la circulación sistémica en comparación con la circulación portal se han implicado en la génesis de la obesidad.58. El DCCT también mostró un mayor aumento de peso en los participantes asignados al azar al grupo de terapia intensiva que tenían antecedentes familiares de diabetes tipo 2 que en aquellos que no tenían antecedentes familiares, lo que sugiere una contribución genética.59. Una mejor comprensión de todos estos mecanismos probables puede conducir a mejores tratamientos en el futuro.
Las opciones actuales para el tratamiento de la obesidad en pacientes con diabetes tipo 1 son limitadas, especialmente en comparación con las opciones de tratamiento para pacientes con diabetes tipo 2. Se debe fomentar la modificación del estilo de vida, pero la alimentación defensiva para evitar la hipoglucemia dificulta este enfoque y se asocia con la recuperación de peso. Los datos que respaldan agentes como fentermina, fentermina-topiramato o naltrexona-bupropión son limitados, por lo que estos medicamentos rara vez se usan en esta población.
Se ha demostrado que la cirugía bariátrica (también denominada “cirugía metabólica”) es una opción eficaz y relativamente segura para pacientes con diabetes tipo 1 y obesidad. En un estudio en el que participaron 147 personas con diabetes tipo 1 sometidas a bypass gástrico en Y de Roux o gastrectomía en manga, la reducción de peso fue similar independientemente del procedimiento utilizado, con reducciones paralelas en las necesidades de insulina al año.60. Datos de 17 estudios que incluyeron un total de 107 personas con diabetes tipo 1 que se sometieron a cirugía bariátrica mostraron una reducción significativa pero modesta en los niveles de hemoglobina glucosilada junto con la pérdida de peso.61.
Varios ensayos clínicos han examinado el efecto de los miméticos de incretina sobre el control glucémico y el peso corporal en personas con diabetes tipo 1(62-64). Aunque los resultados del ensayo no respaldan un efecto aditivo de los miméticos de incretina sobre el control glucémico, los pacientes experimentaron consistentemente una pérdida de peso, principalmente como resultado de la supresión del apetito.65. Se ha informado hiperglucemia con cetosis en algunos ensayos(62,63,66). Los agonistas del receptor GLP-1 liraglutida y semaglutida actualmente están aprobados por la FDA para el tratamiento de la obesidad, pero no se han estudiado específicamente en pacientes con diabetes tipo 1. Los médicos que prescriben estos agentes a pacientes con diabetes tipo 1 deben permanecer atentos a una posible hipoglucemia posprandial debido al retraso en el vaciamiento gástrico. Se necesitan estudios para evaluar los efectos de los agonistas del receptor de GLP-1 de acción más prolongada y los agonistas combinados del receptor del polipéptido insulinotrópico dependiente de glucosa-GLP-1 sobre el peso corporal y los resultados cardiovasculares en pacientes con diabetes tipo 1.
Terapia antitrombótica
La importancia del tratamiento antiplaquetario para la prevención secundaria de la enfermedad cardiovascular aterosclerótica en todas las personas, tengan o no diabetes, está bien establecida.36. Los ensayos clínicos que examinaron el papel de la aspirina para la prevención primaria de la enfermedad cardiovascular en pacientes con diabetes tipo 1 han arrojado resultados resultados contradictorios.67-69. La ADA actualmente sugiere el uso de aspirina en dosis bajas como prevención primaria en pacientes mayores de 50 años y con diabetes (cualquier tipo) y al menos un factor de riesgo adicional (antecedentes familiares de enfermedad prematura) enfermedad cardiovascular aterosclerótica, hipertensión, dislipidemia, tabaquismo o enfermedad renal crónica o albuminuria). 36. Se justifica una consideración cuidadosa del riesgo individual de hemorragia antes de iniciar el tratamiento. 36. Debido a que las personas con diabetes tipo 1 y niveles elevados de hemoglobina glucosilada tienen una inhibición reducida de agregación plaquetaria con el uso de aspirina(70), mejorar el control glucémico puede ser útil para potenciar los efectos de la aspirina. Desafortunadamente, hay poca información disponible sobre el uso de inhibidores de los receptores de glicoproteína IIb/IIIa en pacientes con diabetes tipo 1.
Evaluación del riesgo de enfermedades cardiovasculares
Los médicos deben realizar una evaluación del riesgo cardiovascular anualmente para los pacientes con diabetes tipo 1 y abordar los factores de riesgo modificables.36. Los síntomas cardíacos y los hallazgos anormales en el examen físico deben dictar la necesidad de exámenes de detección adicionales con electrocardiografía o pruebas cardíacas adicionales.36.
La puntuación de calcio en las arterias coronarias (CAC) ha surgido como una herramienta para guiar el inicio de terapias farmacológicas que se sabe que reducen el riesgo de enfermedad cardiovascular. Un análisis de las puntuaciones CAC en participantes de DCCT/EDIC proporcionó evidencia del poder predictivo de la puntuación.71. Una puntuación CAC de 100 o más se asoció con un mayor riesgo de enfermedad cardiovascular tanto en personas con como en aquellas sin diabetes tipo 1. Un análisis de los datos de los pacientes que no tenían diabetes en la cohorte del Estudio Multiétnico de Aterosclerosis (MESA) mostró que una puntuación CAC de 100 o más se asociaba con una estimación favorable de riesgo-beneficio para el uso de aspirina, mientras que Se estimó que un valor de 0 confería daño neto a la aspirina.72. Estos datos no provienen de pacientes con diabetes tipo 1, pero pueden extrapolarse razonablemente a aquellos con diabetes tipo 1. De manera similar, una puntuación CAC de 0 en adultos jóvenes (<40 años de edad) sin factores de riesgo cardiovascular puede usarse para sugerir retrasar el inicio del tratamiento con estatinas, con evaluaciones repetidas del CAC a intervalos de 5 años.73. Después del inicio del tratamiento con estatinas , no hay indicación para reevaluar la puntuación CAC, ya que las estatinas pueden provocar aumentos en la puntuación debido al aumento de la densidad y estabilización de la placa.74.
Se recomienda la evaluación de los niveles de lipoproteína(a) como herramienta adicional para la estratificación del riesgo cardiovascular. Varias sociedades científicas respaldan la medición de los niveles de lipoproteína (a) al menos una vez en todos los adultos y en jóvenes con antecedentes familiares de enfermedad cardiovascular aterosclerótica prematura, considerando el inicio más temprano o una terapia más intensiva con estatinas para reducir el riesgo de enfermedad cardiovascular entre pacientes con niveles elevados de lipoproteína (a)(75,76). Un análisis observacional mostró que en personas con diabetes tipo 1, un nivel elevado de lipoproteína (a) (>50 mg por decilitro) es un factor de riesgo para el desarrollo de enfermedades cardiovasculares y albuminuria y se asocia con un control glucémico deficiente.77.
Manejo no farmacológico de la enfermedad arterial coronaria
El proceso aterosclerótico en las arterias coronarias es difuso. Aunque las decisiones sobre cómo manejar los síntomas en pacientes con enfermedad multivaso deben individualizarse y los datos son limitados, los resultados después de un injerto de derivación de arteria coronaria pueden ser más favorables que los de una intervención coronaria percutánea. En un estudio observacional realizado en Suecia, se comparó a 683 pacientes con diabetes tipo 1 sometidos a injerto de derivación de arteria coronaria durante un período medio de 10,6 años con 1.863 pacientes sometidos a intervención coronaria percutánea. Aunque el riesgo de muerte por cualquier causa fue similar en los dos grupos, el riesgo de infarto de miocardio, muerte por causas cardiovasculares o necesidad de repetir la revascularización fue mayor después de la intervención coronaria percutánea.77.
Insuficiencia cardíaca en la diabetes tipo 1
Múltiples mecanismos explican la insuficiencia cardíaca en pacientes con diabetes, incluida la enfermedad aterosclerótica, la hipertensión y la enfermedad renal diabética, así como la miocardiopatía diabética, un término que puede implicar un papel para la lesión microvascular.78,79. Además, se ha descrito la autoinmunidad cardíaca como mecanismo que conduce a la miocardiopatía en pacientes con diabetes tipo 1(80). Un metanálisis reciente que incluyó a 61.885 pacientes con o sin diabetes tipo 1 que fueron seguidos durante 1 a 12 años mostró un riesgo relativo ajustado de insuficiencia cardíaca de 3,4 (95% IC, 2,71 a 4,26) entre pacientes con diabetes tipo 1(81). El riesgo fue aproximadamente 5 veces mayor para las mujeres y 3 veces mayor para los hombres que el riesgo para los controles del mismo sexo.
Aunque la mayoría de los datos sobre las pruebas de biomarcadores para predecir la aparición de insuficiencia cardíaca corresponden a personas con diabetes tipo 2, la información disponible indica que se puede hacer una predicción similar para personas con diabetes tipo 1. Por ejemplo, entre 1.093 adultos con diabetes tipo 1 pero sin enfermedad cardíaca conocida, la tasa de incidencia de eventos cardiovasculares adversos importantes después de 6,3 años fue de 41 por 1.000 personas-año para un péptido natriurético pro-tipo B N-terminal (NT-ProBNP). ) nivel superior a 300 pg por mililitro versus 10 por 1000 personas-año para un nivel de NT-proBNP inferior a 150 pg por mililitro.82. Los bloqueadores del sistema renina-angiotensina-aldosterona son los agentes preferidos en el tratamiento de la insuficiencia cardíaca en estadio A o B en personas con diabetes tipo 1 e hipertensión, especialmente en presencia de albuminuria, enfermedad de las arterias coronarias o ambas.83. Un cardiólogo experimentado debe participar en el tratamiento de la insuficiencia cardíaca avanzada en cualquier paciente determinado.
El uso de inhibidores del cotransportador de sodio-glucosa 2 (SGLT2) ha revolucionado la atención cardiovascular y renal de las personas con diabetes tipo 2. Algunos ensayos clínicos también han examinado la eficacia hipoglucemiante de estos agentes cuando se utilizan como complemento de la terapia con insulina en pacientes con diabetes tipo 1. En general, los ensayos han demostrado un modesto efecto reductor de la glucosa en sangre junto con un mayor riesgo de cetoacidosis e hipoglucemia.84. Los datos del mundo real han indicado que el perfil de efectos secundarios de los inhibidores de SGLT2 en pacientes con diabetes tipo 1 es similar al de pacientes con diabetes tipo 2(85,86). La FDA aprobó recientemente el inhibidor dual de SGLT1 y SGLT2 sotagliflozina para el tratamiento de la insuficiencia cardíaca, sin limitar su uso en pacientes con diabetes tipo 1. El prospecto recomienda el control de cetonas en esta población. De manera similar, se han informado estrategias para mitigar el riesgo de cetoacidosis(87,88), pero se necesitan estudios adicionales para respaldar mejor el uso regular de inhibidores de SGLT2 en la atención clínica de personas que tienen diabetes tipo 1 e insuficiencia cardíaca, con o sin insuficiencia renal crónica.
Conclusiones
Hay muchas preguntas sobre los enfoques para mitigar el riesgo de enfermedad cardiovascular entre pacientes con diabetes tipo 1, incluido el momento y la dosis de las estatinas, los objetivos específicos de presión arterial, el uso de aspirina para la prevención primaria, la eficacia comparativa de la terapia mimética de incretinas y cirugía bariátrica y los riesgos y beneficios de la inhibición de SGLT2. ¿Cuál de estas posibles intervenciones requiere un estudio más riguroso mediante un ensayo clínico aleatorizado? Actualmente, la prevención de enfermedades cardiovasculares en personas con diabetes tipo 1 debe depender de datos de estudios observacionales y, en algunas circunstancias, de datos obtenidos del pequeño número de pacientes con diabetes tipo 1 que han sido incluidos en ensayos que involucran principalmente a pacientes con diabetes tipo 2. Los datos del mundo real y la inteligencia artificial pueden ayudar a responder algunas preguntas. La enfermedad cardiovascular es la principal causa de enfermedad importante y muerte en pacientes con diabetes tipo 1, y los datos de observación siguen siendo la base para las decisiones sobre la terapia, ya que falta evidencia de ensayos clínicos aleatorios . Hasta que dicha evidencia esté disponible, las recomendaciones actuales de muchas organizaciones profesionales sin fines de lucro son útiles, pero deben compararse y consolidarse.
Referencias Bibliográficas
1.
International Diabetes Federation. IDF diabetes atlas. 2021 (https://diabetesatlas.org/).
2.
Leslie RD, Evans-Molina C, Freund-Brown J, et al. Adult-onset type 1 diabetes: current understanding and challenges. Diabetes Care 2021;44:2449-2456.
3.
Tran-Duy A, Knight J, Palmer AJ, et al. A patient-level model to estimate lifetime health outcomes of patients with type 1 diabetes. Diabetes Care 2020;43:1741-1749.
4.
Secrest AM, Becker DJ, Kelsey SF, Laporte RE, Orchard TJ. Cause-specific mortality trends in a large population-based cohort with long-standing childhood-onset type 1 diabetes. Diabetes 2010;59:3216-3222.
5.
Krolewski AS, Kosinski EJ, Warram JH, et al. Magnitude and determinants of coronary artery disease in juvenile-onset, insulin-dependent diabetes mellitus. Am J Cardiol 1987;59:750-755.
6.
Soedamah-Muthu SS, Fuller JH, Mulnier HE, Raleigh VS, Lawrenson RA, Colhoun HM. High risk of cardiovascular disease in patients with type 1 diabetes in the U.K.: a cohort study using the general practice research database. Diabetes Care 2006;29:798-804.
7.
Janghorbani M, Hu FB, Willett WC, et al. Prospective study of type 1 and type 2 diabetes and risk of stroke subtypes: the Nurses’ Health Study. Diabetes Care 2007;30:1730-1735.
8.
Shankar A, Klein R, Klein BEK, Moss SE. Association between glycosylated hemoglobin level and cardiovascular and all-cause mortality in type 1 diabetes. Am J Epidemiol 2007;166:393-402.
9.
Deckert T, Poulsen JE, Larsen M. Prognosis of diabetics with diabetes onset before the age of thirty-one. I. Survival, causes of death, and complications. Diabetologia 1978;14:363-370.
10.
Singh TP, Groehn H, Kazmers A. Vascular function and carotid intimal-medial thickness in children with insulin-dependent diabetes mellitus. J Am Coll Cardiol 2003;41:661-665.
11.
Järvisalo MJ, Raitakari M, Toikka JO, et al. Endothelial dysfunction and increased arterial intima-media thickness in children with type 1 diabetes. Circulation 2004;109:1750-1755.
12.
Rawshani A, Sattar N, Franzén S, et al. Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: a nationwide, register-based cohort study. Lancet 2018;392:477-486.
13.
Diabetes Control and Complications Trial (DCCT)/Epidemiology of Diabetes Interventions and Complications (EDIC) Study Research Group. Mortality in type 1 diabetes in the DCCT/EDIC versus the general population. Diabetes Care 2016;39:1378-1383.
14.
Lind M, Svensson A-M, Kosiborod M, et al. Glycemic control and excess mortality in type 1 diabetes. N Engl J Med 2014;371:1972-1982.
15.
Huxley RR, Peters SA, Mishra GD, Woodward M. Risk of all-cause mortality and vascular events in women versus men with type 1 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol 2015;3:198-206.
16.
Eckel RH, Bornfeldt KE, Goldberg IJ. Cardiovascular disease in diabetes, beyond glucose. Cell Metab 2021;33:1519-1545.
17.
Djaberi R, Schuijf JD, Boersma E, et al. Differences in atherosclerotic plaque burden and morphology between type 1 and 2 diabetes as assessed by multislice computed tomography. Diabetes Care 2009;32:1507-1512.
18.
Janssen AWM, van Heck JIP, Stienstra R, et al. Arterial wall inflammation assessed by 18F-FDG-PET/CT is higher in individuals with type 1 diabetes and associated with circulating inflammatory proteins. Cardiovasc Res 2023;119:1942-1951.
19.
Reaven GM. Banting lecture 1988: role of insulin resistance in human disease. Diabetes 1988;37:1595-1607.
20.
Orchard TJ, Olson JC, Erbey JR, et al. Insulin resistance-related factors, but not glycemia, predict coronary artery disease in type 1 diabetes: 10-year follow-up data from the Pittsburgh Epidemiology of Diabetes Complications Study. Diabetes Care 2003;26:1374-1379.
21.
Bjornstad P, Maahs DM, Duca LM, et al. Estimated insulin sensitivity predicts incident micro- and macrovascular complications in adults with type 1 diabetes over 6 years: the coronary artery calcification in type 1 diabetes study. J Diabetes Complications 2016;30:586-590.
22.
Schauer IE, Snell-Bergeon JK, Bergman BC, et al. Insulin resistance, defective insulin-mediated fatty acid suppression, and coronary artery calcification in subjects with and without type 1 diabetes: the CACTI study. Diabetes 2011;60:306-314.
23.
Pambianco G, Costacou T, Orchard TJ. The prediction of major outcomes of type 1 diabetes: a 12-year prospective evaluation of three separate definitions of the metabolic syndrome and their components and estimated glucose disposal rate: the Pittsburgh Epidemiology of Diabetes Complications Study experience. Diabetes Care 2007;30:1248-1254.
24.
Orchard TJ, Secrest AM, Miller RG, Costacou T. In the absence of renal disease, 20 year mortality risk in type 1 diabetes is comparable to that of the general population: a report from the Pittsburgh Epidemiology of Diabetes Complications Study. Diabetologia 2010;53:2312-2319.
25.
Groop P-H, Thomas MC, Moran JL, et al. The presence and severity of chronic kidney disease predicts all-cause mortality in type 1 diabetes. Diabetes 2009;58:1651-1658.
26.
Lewis EJ, Hunsicker LG, Bain RP, Rohde RD. The effect of angiotensin-converting–enzyme inhibition on diabetic nephropathy. N Engl J Med 1993;329:1456-1462.
27.
Heart Outcomes Prevention Evaluation Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Lancet 2000;355:253-259.
28.
Rawshani A, Rawshani A, Sattar N, et al. Relative prognostic importance and optimal levels of risk factors for mortality and cardiovascular outcomes in type 1 diabetes mellitus. Circulation 2019;139:1900-1912.
29.
Barlovic DP, Soro-Paavonen A, Jandeleit-Dahm KAM. RAGE biology, atherosclerosis and diabetes. Clin Sci (Lond) 2011;121:43-55.
30.
Egaña-Gorroño L, López-Díez R, Yepuri G, et al. Receptor for advanced glycation end products (RAGE) and mechanisms and therapeutic opportunities in diabetes and cardiovascular disease: insights from human subjects and animal models. Front Cardiovasc Med 2020;7:37-37.
31.
The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-986.
32.
Nathan DM, Cleary PA, Backlund J-YC, et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005;353:2643-2653.
33.
Diabetes Control and Complications Trial (DCCT)/Epidemiology of Diabetes Interventions and Complications (EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular outcomes in type 1 diabetes: the DCCT/EDIC study 30-year follow-up. Diabetes Care 2016;39:686-693.
34.
de Boer IH, Kestenbaum B, Rue TC, et al. Insulin therapy, hyperglycemia, and hypertension in type 1 diabetes mellitus. Arch Intern Med 2008;168:1867-1873.
35.
Hero C, Rawshani A, Svensson A-M, et al. Association Between use of lipid-lowering therapy and cardiovascular diseases and death in individuals with type 1 diabetes. Diabetes Care 2016;39:996-1003.
36.
ElSayed NA, Aleppo G, Aroda VR, et al. Cardiovascular disease and risk management: standards of care in diabetes — 2023. Diabetes Care 2023;46:Suppl 1:S158-S190.
37.
Marx N, Federici M, Schütt K, et al. 2023 ESC guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J 2023;44:4043-4140.
38.
Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA guideline on the primary prevention of cardiovascular disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019;140(11):e596-e646.
39.
Vistisen D, Andersen GS, Hansen CS, et al. Prediction of first cardiovascular disease event in type 1 diabetes mellitus: the Steno Type 1 Risk Engine. Circulation 2016;133:1058-1066.
40.
Hippisley-Cox J, Coupland C, Brindle P. Development and validation of QRISK3 risk prediction algorithms to estimate future risk of cardiovascular disease: prospective cohort study. BMJ 2017;357:j2099-j2099.
41.
ElSayed NA, Aleppo G, Aroda VR, et al. Children and adolescents: standards of care in diabetes — 2023. Diabetes Care 2023;46:Suppl 1:S230-S253.
42.
Levenson AE, Wadwa RP, Shah AS, et al. PCSK9 is increased in youth with type 1 diabetes. Diabetes Care 2017;40(7):e85-e87.
43.
Bojanin D, Vekic J, Milenkovic T, et al. Association between proprotein convertase subtilisin/kexin 9 (PCSK9) and lipoprotein subclasses in children with type 1 diabetes mellitus: effects of glycemic control. Atherosclerosis 2019;280:14-20.
44.
Bjornstad P, Dart A, Donaghue KC, et al. ISPAD clinical practice consensus guidelines 2022: microvascular and macrovascular complications in children and adolescents with diabetes. Pediatr Diabetes 2022;23:1432-1450.
45.
Food and Drug Administration. FDA requests removal of strongest warning against using cholesterol-lowering statins during pregnancy: still advises most pregnant patients should stop taking statins. FDA Drug Safety Podcast. 2021 ().
46.
Collado-Mesa F, Colhoun HM, Stevens LK, et al. Prevalence and management of hypertension in type 1 diabetes mellitus in Europe: the EURODIAB IDDM Complications Study. Diabet Med 1999;16:41-48.
47.
Maahs DM, Kinney GL, Wadwa P, et al. Hypertension prevalence, awareness, treatment, and control in an adult type 1 diabetes population and a comparable general population. Diabetes Care 2005;28:301-306.
48.
Wallace AS, Chang AR, Shin J-I, et al. Obesity and chronic kidney disease in US adults with type 1 and type 2 diabetes mellitus. J Clin Endocrinol Metab 2022;107:1247-1256.
49.
de Boer IH, Bangalore S, Benetos A, et al. Diabetes and hypertension: a position statement by the American Diabetes Association. Diabetes Care 2017;40:1273-1284.
50.
Brenner BM, Cooper ME, de Zeeuw D, et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med 2001;345:861-869.
51.
Guo J, Brooks MM, Muldoon MF, Naimi AI, Orchard TJ, Costacou T. Optimal blood pressure thresholds for minimal coronary artery disease risk in type 1 diabetes. Diabetes Care 2019;42:1692-1699.
52.
ter Braak EW, Appelman AM, van de Laak M, Stolk RP, van Haeften TW, Erkelens DW. Clinical characteristics of type 1 diabetic patients with and without severe hypoglycemia. Diabetes Care 2000;23:1467-1471.
53.
Foster NC, Beck RW, Miller KM, et al. State of type 1 diabetes management and outcomes from the T1D exchange in 2016-2018. Diabetes Technol Ther 2019;21:66-72.
54.
Fang M, Jeon Y, Echouffo-Tcheugui JB, Selvin E. Prevalence and management of obesity in U.S. adults with type 1 diabetes. Ann Intern Med 2023;176:427-429.
55.
The DCCT Research Group. Weight gain associated with intensive therapy in the Diabetes Control and Complications Trial. Diabetes Care 1988;11:567-573.
56.
Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group. Modern-day clinical course of type 1 diabetes mellitus after 30 years’ duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983-2005). Arch Intern Med 2009;169:1307-1316.
57.
Purnell JQ, Zinman B, Brunzell JD. The effect of excess weight gain with intensive diabetes mellitus treatment on cardiovascular disease risk factors and atherosclerosis in type 1 diabetes mellitus: results from the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study (DCCT/EDIC) study. Circulation 2013;127:180-187.
58.
Corbin KD, Driscoll KA, Pratley RE, et al. Obesity in type 1 diabetes: pathophysiology, clinical impact, and mechanisms. Endocr Rev 2018;39:629-663.
59.
Purnell JQ, Dev RK, Steffes MW, et al. Relationship of family history of type 2 diabetes, hypoglycemia, and autoantibodies to weight gain and lipids with intensive and conventional therapy in the Diabetes Control and Complications Trial. Diabetes 2003;52:2623-2629.
60.
Thaher O, Iaroshevych V, Driouch J, Hukauf M, Croner RS, Stroh C. Current status of metabolic surgery in patients with type I diabetes mellitus and obesity: a nationwide multicenter study. Langenbecks Arch Surg 2023;408:46-46.
61.
Kirwan JP, Aminian A, Kashyap SR, Burguera B, Brethauer SA, Schauer PR. Bariatric surgery in obese patients with type 1 diabetes. Diabetes Care 2016;39:941-948.
62.
Johansen NJ, Dejgaard TF, Lund A, et al. Efficacy and safety of meal-time administration of short-acting exenatide for glycaemic control in type 1 diabetes (MAG1C): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2020;8:313-324.
63.
Mathieu C, Zinman B, Hemmingsson JU, et al. Efficacy and safety of liraglutide added to insulin treatment in type 1 diabetes: the ADJUNCT ONE treat-to-target randomized trial. Diabetes Care 2016;39:1702-1710.
64.
Dejgaard TF, Frandsen CS, Hansen TS, et al. Efficacy and safety of liraglutide for overweight adult patients with type 1 diabetes and insufficient glycaemic control (Lira-1): a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol 2016;4:221-232.
65.
Nauck MA, Meier JJ. GLP-1 receptor agonists in type 1 diabetes: a MAG1C bullet? Lancet Diabetes Endocrinol 2020;8:262-264.
66.
Ahrén B, Hirsch IB, Pieber TR, et al. Efficacy and safety of liraglutide added to capped insulin treatment in subjects with type 1 diabetes: the ADJUNCT TWO randomized trial. Diabetes Care 2016;39:1693-1701.
67.
Early Treatment Diabetic Retinopathy Study design and baseline patient characteristics: ETDRS report number 7. Ophthalmology 1991;98:Suppl:741-756.
68.
Belch J, MacCuish A, Campbell I, et al. The prevention of progression of arterial disease and diabetes (POPADAD) trial: factorial randomised placebo controlled trial of aspirin and antioxidants in patients with diabetes and asymptomatic peripheral arterial disease. BMJ 2008;337:a1840-a1840.
69.
De Berardis G, Sacco M, Strippoli GFM, et al. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomised controlled trials. BMJ 2009;339:b4531-b4531.
70.
Parker WAE, Sagar R, Kurdee Z, et al. A randomised controlled trial to assess the antithrombotic effects of aspirin in type 1 diabetes: role of dosing and glycaemic control. Cardiovasc Diabetol 2021;20:238-238.
71.
Budoff M, Backlund J-YC, Bluemke DA, et al. The association of coronary artery calcification with subsequent incidence of cardiovascular disease in type 1 diabetes: the DCCT/EDIC trials. JACC Cardiovasc Imaging 2019;12:1341-1349.
72.
Miedema MD, Duprez DA, Misialek JR, et al. Use of coronary artery calcium testing to guide aspirin utilization for primary prevention: estimates from the multi-ethnic study of atherosclerosis. Circ Cardiovasc Qual Outcomes 2014;7:453-460.
73.
Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation 2019;139(25):e1082-e1143.
74.
Puri R, Nicholls SJ, Shao M, et al. Impact of statins on serial coronary calcification during atheroma progression and regression. J Am Coll Cardiol 2015;65:1273-1282.
75.
Kronenberg F, Mora S, Stroes ESG, et al. Lipoprotein(a) in atherosclerotic cardiovascular disease and aortic stenosis: a European Atherosclerosis Society consensus statement. Eur Heart J 2022;43:3925-3946.
76.
Wilson DP, Jacobson TA, Jones PH, et al. Use of Lipoprotein(a) in clinical practice: a biomarker whose time has come: a scientific statement from the National Lipid Association. J Clin Lipidol 2019;13:374-392.
77.
Nyström T, Sartipy U, Franzén S, et al. PCI versus CABG in patients with type 1 diabetes and multivessel disease. J Am Coll Cardiol 2017;70:1441-1451.
78.
Lee MMY, McMurray JJV, Lorenzo-Almorós A, et al. Diabetic cardiomyopathy. Heart 2019;105:337-345.
79.
Li F-R, Hukportie DN, Yang J, Yang H-H, Chen G-C, Wu X-B. Microvascular burden and incident heart failure among middle-aged and older adults with type 1 or type 2 diabetes. Diabetes Care 2022;45:2999-3006.
80.
Sousa GR, Kosiborod M, Bluemke DA, Lipes MA. Cardiac autoimmunity is associated with subclinical myocardial dysfunction in patients with type 1 diabetes mellitus. Circulation 2020;141:1107-1109.
81.
Haji M, Erqou S, Fonarow GC, Echouffo-Tcheugui JB. Type 1 diabetes and risk of heart failure: a systematic review and meta-analysis. Diabetes Res Clin Pract 2023;202:110805-110805.
82.
Rørth R, Jørgensen PG, Andersen HU, et al. Cardiovascular prognostic value of echocardiography and N terminal pro B-type natriuretic peptide in type 1 diabetes: the Thousand & 1 Study. Eur J Endocrinol 2020;182:481-488.
83.
Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022;145(18):e895-e1032.
84.
Taylor SI, Blau JE, Rother KI, Beitelshees AL. SGLT2 inhibitors as adjunctive therapy for type 1 diabetes: balancing benefits and risks. Lancet Diabetes Endocrinol 2019;7:949-958.
85.
Edwards K, Li X, Lingvay I. Clinical and safety outcomes with GLP-1 receptor agonists and SGLT2 inhibitors in type 1 diabetes: a real-world study. J Clin Endocrinol Metab 2023;108:920-930.
86.
Anson M, Zhao SS, Austin P, Ibarburu GH, Malik RA, Alam U. SGLT2i and GLP-1 RA therapy in type 1 diabetes and reno-vascular outcomes: a real-world study. Diabetologia 2023;66:1869-1881.
87.
Teng R, Kurian M, Close KL, Buse JB, Peters AL, Alexander CM. Comparison of protocols to reduce diabetic ketoacidosis in patients with type 1 diabetes prescribed a sodium-glucose cotransporter 2 inhibitor. Diabetes Spectr 2021;34:42-51.
88.
Danne T, Garg S, Peters AL, et al. International consensus on risk management of diabetic ketoacidosis in patients with type 1 diabetes treated with sodium-glucose cotransporter (SGLT) inhibitors. Diabetes Care 2019;42:1147-1154.